Với giải Thí nghiệm 3 trang 97 Hóa học lớp 12 Cánh diều chi tiết trong Bài 14: Tính chất hoá học của kim loại giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 14: Tính chất hoá học của kim loại
Thí nghiệm 3 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch hydrochloric acid
Chuẩn bị:
- Hoá chất: Lá đồng, băng magnesium, dung dịch hydrochloric acid 1 M.
- Dụng cụ: Ống nghiệm.
Tiến hành: Cho vào hai ống nghiệm mỗi ống khoảng 2 mL dung dịch HCl 1 M. Cho tiếp là đồng vào ống nghiệm (1), băng magnesium vào ống nghiệm (2).
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Lời giải:
- Hiện tượng: Ở ống nghiệm (1) không có hiện tượng xảy ra. Ở ống nghiệm (2) thấy sủi bọt khí không màu, băng magnesium tan dần.
- Giải thích: Lá đồng không phản ứng với dung dịch hydrochloric acid. Băng magnesium phản ứng với dung dịch hydrochloric acid giải phóng khí hydrogen.
+ Phương trình hóa học:
Mg(s) + 2HCl (aq) ⟶ MgCl2 (aq)+ H2(g)
Lý thuyết Tác dụng với dung dịch acid
1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng
Do nên kim loại M có giá trị thế điện cực chuẩn có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2
Ví dụ: Zn(s) + 2H+(aq) Zn2+ (aq) + H2(g)
Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
2. Tác dụng với dung dịch sulfuric acid đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: 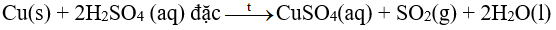
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Thí nghiệm 1 trang 96 Hóa học 12: Kim loại tác dụng với oxygen trong không khí...
Luyện tập 2 trang 97 Hóa học 12: Cho = −2,925 V, = 0,854 V....
Thí nghiệm 2 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch muối...
Thí nghiệm 3 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch hydrochloric acid...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 13. Cấu tạo và tính chất vật lí của kim loại
Bài 14. Tính chất hoá học của kim loại
Bài 15. Tách kim loại và tái chế kim loại