Với giải Luyện tập 2 trang 97 Hóa học lớp 12 Cánh diều chi tiết trong Bài 14: Tính chất hoá học của kim loại giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 14: Tính chất hoá học của kim loại
Luyện tập 2 trang 97 Hóa học 12: Cho = −2,925 V, = 0,854 V.
a) Cho biết vì sao potassium phản ứng được với nước. Viết phương trình hóa học của phản ứng xảy ra.
b) Giải thích vì sao thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
Lời giải:
- Trong môi trường trung tính, có:
2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V
a) Ta có = −2,925 V < –0,413 V nên potassium phản ứng được với nước.
2K(s) + 2H2O(l) ⟶ 2KOH(aq) + H2(g)
b) Ta có = 0,854 V > –0,413 V nên thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
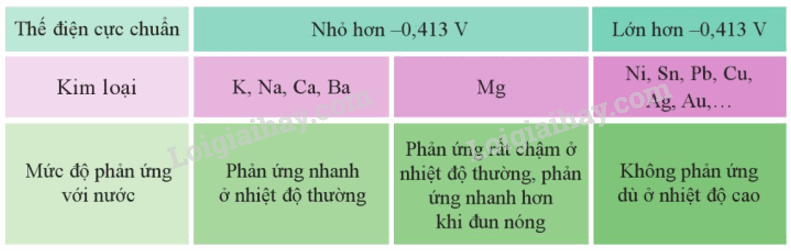
Lý thuyết Tác dụng với nước
Trong môi trường trung tính, có:
2H2O + 2e H2 + OH- với E2H2O/2OH-+H2 = -0,413V
Cặp oxi hóa – khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn – 0,413V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Thí nghiệm 1 trang 96 Hóa học 12: Kim loại tác dụng với oxygen trong không khí...
Luyện tập 2 trang 97 Hóa học 12: Cho = −2,925 V, = 0,854 V....
Thí nghiệm 2 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch muối...
Thí nghiệm 3 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch hydrochloric acid...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 13. Cấu tạo và tính chất vật lí của kim loại
Bài 14. Tính chất hoá học của kim loại
Bài 15. Tách kim loại và tái chế kim loại