Lời giải bài tập Hóa học lớp 12 Bài 14: Tính chất hoá học của kim loại sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 14: Tính chất hoá học của kim loại
Lời giải:
Ở nhiệt độ thường:
- Những kim loại có thể phản ứng được với dung dịch HCl 1 M là: Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb…
- Những kim loại có thể phản ứng được với H2O để tạo ra H2 là: Li, K, Ba, Ca, Na…
Giải thích:
- Trong môi trường trung tính, có:
2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V
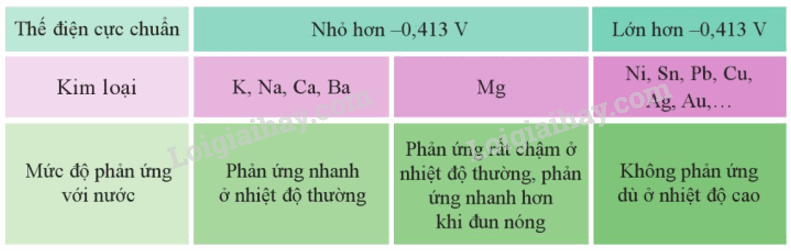
Cặp oxi hóa – khử Mn+/M của các kim loại Li, K, Ba, Ca, Na có giá trị thế điện cực chuẩn nhỏ hơn – 0,413 V nên các kim loại đó có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen.
- Trong môi trường acid, có:
2H+ + 2e ⟶ H2 với = 0 V
Cặp oxi hóa – khử Mn+/M của các kim loại Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb có thế điện cực chuẩn nhỏ hơn 0 V có thể khử được ion H+ trong dung dịch acid tạo thành khí H2.
Cần nhớ:
- Mg phản ứng rất chậm với nước ở nhiệt độ thường, phản ứng nhanh hơn khi đun nóng.
- Al tác dụng được với nước. Tuy nhiên, phản ứng nhanh chóng dừng lại vì sản phẩm hydroxide không tan ngăn cản nhôm phản ứng với nước.
Lời giải:
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu.
- Các kim loại được sắp xếp theo chiều giảm dần tính khử là: K, Na, Al, Fe, Cu.
Lời giải:
2Zn(s) + O2 (g) 2ZnO(s)
Zn(s) + S (s) ZnS(s)
Zn(s) + Cl2 (g) ZnCl2(s)
Thí nghiệm 1 trang 96 Hóa học 12: Kim loại tác dụng với oxygen trong không khí
Chuẩn bị:
- Hoá chất: Băng magnesium dài khoảng 3 cm - 5 cm.
- Dụng cụ: Đèn cồn, bật lửa, kẹp đốt hoá chất.
Tiến hành: Dùng kẹp đốt hoá chất đưa đoạn băng magnesium vào ngọn lửa đèn cồn.
Yêu cầu: Quan sát và giải thích hiện tượng, viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
- Hiện tượng: Phản ứng xảy ra mãnh liệt, tỏa nhiều nhiệt, phát ra ánh sáng chói và xuất hiện khói trắng.
- Giải thích: Khói trắng đó là magnesium oxide (MgO) sinh ra.
+ Phương trình hóa học:
2Mg(s) + O2 (g) 2MgO(s)
+ Sản phẩm thu được là chất rắn có màu trắng (MgO).
Luyện tập 2 trang 97 Hóa học 12: Cho = −2,925 V, = 0,854 V.
a) Cho biết vì sao potassium phản ứng được với nước. Viết phương trình hóa học của phản ứng xảy ra.
b) Giải thích vì sao thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
Lời giải:
- Trong môi trường trung tính, có:
2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V
a) Ta có = −2,925 V < –0,413 V nên potassium phản ứng được với nước.
2K(s) + 2H2O(l) ⟶ 2KOH(aq) + H2(g)
b) Ta có = 0,854 V > –0,413 V nên thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
Thí nghiệm 2 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch muối
Chuẩn bị:
- Hoá chất: Đinh sắt đã được đánh sạch bề mặt, dung dịch copper(II) sulfate 1 M.
- Dụng cụ: Cốc thuỷ tinh.
Tiến hành: Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch copper(II) sulfate 1 M.
Yêu cầu: Sau khoảng 10 phút, quan sát, mô tả hiện tượng và giải thích.
Lời giải:
- Hiện tượng: Xuất hiện lớp chất rắn màu đỏ bám trên đinh sắt, màu xanh của dung dịch nhạt dần.
- Giải thích: Sản phẩm thu được là Cu ở thể rắn và có màu đỏ. CuSO4 đã tham gia phản ứng nên nồng độ giảm dần làm cho màu dung dịch nhạt dần đi.
+ Phương trình hóa học:
Fe(s) + CuSO4 (aq) ⟶ FeSO4 (aq)+ Cu(s)
+ Do = −0,44 V < = 0,34 V nên sắt dễ dàng đẩy đồng ra khỏi dung dịch copper(II) sulfate.
Thí nghiệm 3 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch hydrochloric acid
Chuẩn bị:
- Hoá chất: Lá đồng, băng magnesium, dung dịch hydrochloric acid 1 M.
- Dụng cụ: Ống nghiệm.
Tiến hành: Cho vào hai ống nghiệm mỗi ống khoảng 2 mL dung dịch HCl 1 M. Cho tiếp là đồng vào ống nghiệm (1), băng magnesium vào ống nghiệm (2).
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Lời giải:
- Hiện tượng: Ở ống nghiệm (1) không có hiện tượng xảy ra. Ở ống nghiệm (2) thấy sủi bọt khí không màu, băng magnesium tan dần.
- Giải thích: Lá đồng không phản ứng với dung dịch hydrochloric acid. Băng magnesium phản ứng với dung dịch hydrochloric acid giải phóng khí hydrogen.
+ Phương trình hóa học:
Mg(s) + 2HCl (aq) ⟶ MgCl2 (aq)+ H2(g)
Chuẩn bị:
- Hoá chất: Lá đồng, dung dịch sulfuric acid 1 M, dung dịch sulfuric acid khoảng 70%, giấy quỳ.
- Dụng cụ: Ống nghiệm, kẹp ống nghiệm, bông tẩm nước, đèn cồn, bật lửa.
Tiến hành:
- Cho vào mỗi ống nghiệm chứa dung dịch sulfuric acid loãng và ống nghiệm chứa dung dịch sulfuric acid đặc một lá đồng.
- Đậy mỗi ống nghiệm bằng bông tẩm nước.
- Đun hai ống nghiệm trên ngọn lửa đèn cồn. Sau một thời gian, dùng mẫu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích. Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Chú ý: Cẩn thận khi sử dụng dung dịch sulfuric acid đặc.
Lời giải:
- Hiện tượng: Ở ống nghiệm chứa dung dịch sulfuric acid loãng không có hiện tượng xảy ra. Ở ống nghiệm chứa dung dịch sulfuric acid đặc thấy sủi bọt khí không màu, lá đồng tan dần, bông tẩm nước nút ống nghiệp làm giấy quỳ chuyển đỏ.
- Giải thích:
+ Lá đồng không phản ứng với dung dịch sulfuric acid loãng.
+ Lá đồng phản ứng với dung dịch sulfuric acid đặc nóng giải phóng khí sulfur dioxide. Khí này tan trong nước tạo dung dịch acid làm giấy quỳ chuyển đỏ.
+ Phương trình hóa học:
Cu(s) + 2H2SO4(aq) CuSO4(aq) + SO2(g) + 2H2O(l)
SO2(g)+ H2O(l) ⇌ H2SO3(aq)
Lời giải:
Có = 0 V mà = 0,34 V > 0 V; = 0,799 V > 0 V nên Cu, Ag không khử được ion H+ trong dung dịch hydrochloric acid.
Do đó Cu và Ag không phản ứng với dung dịch hydrochloric acid 1 M.
Lời giải:
Có thể dùng dung dịch sulfuric acid đặc để phân biệt đoạn dây bạc và đoạn dây platinum được.
Vì:
+ Bạc tác dụng được với dung dịch sulfuric acid đặc cho hiện tượng sủi bọt khí và dung dịch xuất hiện vẩn đục trắng.
2Ag(s)+ 2H2SO4(aq) Ag2SO4(s)+ SO2(g)+ 2H2O(l)
+ Platinum không tác dụng được với dung dịch sulfuric acid đặc nên không có hiện tượng xảy ra.
Bài tập
a) Trường hợp nào có phản ứng tạo thành kim loại? Nêu vai trò của mỗi chất tham gia phản ứng.
b) Viết các phương trình hoá học của phản ứng ở dạng ion thu gọn.
Lời giải:
a) Ta có: = −0,44 V; = −1,676 V; = −0,763 V; = 0,34 V; = −0,126 V.
Như vậy sắt có thế điện cực chuẩn nhỏ hơn của đồng và chì.
Trường hợp có phản ứng tạo thành kim loại là:
+ Cho đinh sắt vào dung dịch copper(II) sulfate. Khi đó sắt (Fe) đóng vai trò là chất khử, copper(II) sulfate (CuSO4) đóng vai trò là chất oxi hóa.
+ Cho đinh sắt vào dung dịch lead(II) nitrate. Khi đó sắt (Fe) đóng vai trò là chất khử, lead(II) nitrate (Pb(NO3)2) đóng vai trò là chất oxi hóa.
b) Phương trình hoá học ở dạng ion thu gọn.
Fe(s) + Cu2+(aq) ⟶ Fe2+(aq) + Cu(s)
Fe(s) + Pb2+(aq) ⟶ Fe2+(aq) + Pb(s)
a) Ag(s) + Cu2+ (aq) →
b) Sn(s) + Cu2+ (aq) →
c) Ni(s) + H₂O(1) →
Lời giải:
Có:
= 0,799 V > = 0,34 V nên phản ứng a không xảy ra.
= −0,138 V < = 0,34 V nên phản ứng b xảy ra.
Sn(s) + Cu2+(aq) ⟶ Sn2+(aq) + Cu(s)
= −0,257 V > = – 0,413 V nên phản ứng c không xảy ra.
Lời giải:
Bạc, vàng thường được dùng làm đồ trang sức vì:
+ Tính chất vật lí: kim loại có ánh kim, dễ uốn và dát mỏng. Do đó dễ dàng tạo hình đồ trang sức đa dạng theo ý muốn.
+ Tính chất hóa học: kim loại có giá trị thế điện cực chuẩn cao hay tính khử rất yếu, khó bị oxi hóa. Do đó đồ trang sức làm từ bạc, vàng bền đẹp với thời gian.
Lý thuyết Tính chất hoá học của kim loại
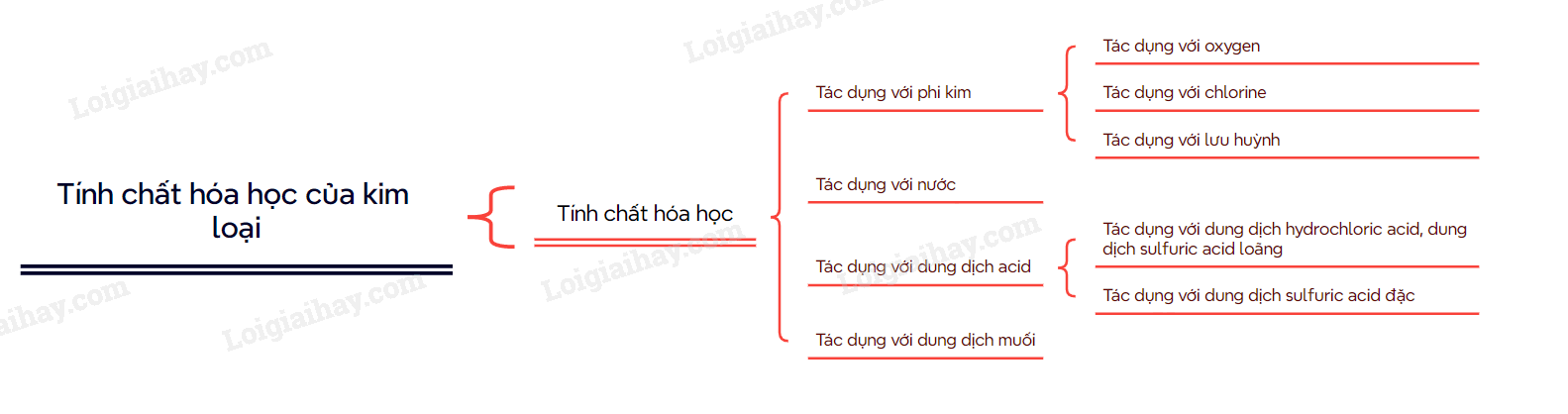
I. Tác dụng với phi kim
Nhiều kim loại tác dụng được với các phi kim như oxygen, lưu huỳnh, halogen,…
Ví dụ:
II. Tác dụng với nước
Trong môi trường trung tính, có:
2H2O + 2e H2 + OH- với E2H2O/2OH-+H2 = -0,413V
Cặp oxi hóa – khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn – 0,413V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen
III. Tác dụng với dung dịch muối
Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực lớn hơn ở điều kiện chuẩn.
Ví dụ: Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s)
IV. Tác dụng với dung dịch acid
1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng
Do nên kim loại M có giá trị thế điện cực chuẩn có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2
Ví dụ: Zn(s) + 2H+(aq) Zn2+ (aq) + H2(g)
Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
2. Tác dụng với dung dịch sulfuric acid đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: 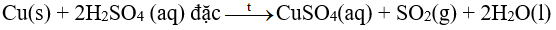
Sơ đồ tư duy Tính chất hóa học của kim loại
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 13. Cấu tạo và tính chất vật lí của kim loại
Bài 14. Tính chất hoá học của kim loại
Bài 15. Tách kim loại và tái chế kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại