Với lời giải SBT Hóa học 11 trang 8 chi tiết trong Bài 1: Khái niệm về cân bằng hoá học sách Kết nối tri thức giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 1: Khái niệm về cân bằng hoá học
Cân bằng hoá học của phản ứng trên sẽ chuyển dịch theo chiều nào nếu:
a) Tăng áp suất của bình phản ứng.
b) Tăng nhiệt độ của phản ứng.
c) Tăng nồng độ của C6H5CH2CH3.
d) Thêm chất xúc tác.
e) Tách styrene ra khỏi bình phản ứng.
Lời giải:
a) Tăng áp suất của bình phản ứng: Cân bằng chuyển dịch theo chiều nghịch là chiều làm giảm số mol khí.
b) Tăng nhiệt độ của phản ứng: Cân bằng chuyển dịch theo chiều thuận tức chiều phản ứng thu nhiệt.
c) Tăng nồng độ của C6H5CH2CH3: Cân bằng chuyển dịch theo chiều thuận, là chiều làm giảm nồng độ của C6H5CH2CH3.
d) Thêm chất xúc tác: Cân bằng không chuyển dịch. Chất xúc tác chỉ làm tăng tốc độ của cả phản ứng thuận và phản ứng nghịch, làm phản ứng nhanh đạt đến trạng thái cân bằng.
e) Tách styrene ra khỏi bình phản ứng: Cân bằng chuyển dịch theo chiều thuận, là chiều làm tăng nồng độ styrene.
Cho 0,75 mol PCl3 và 0,75 mol Cl2 vào bình kín dung tích 8 lít ở 227oC. Tính nồng độ các chất ở trạng thái cân bằng, biết giá trị hằng số cân bằng Kc ở 227oC là 49.
Lời giải:
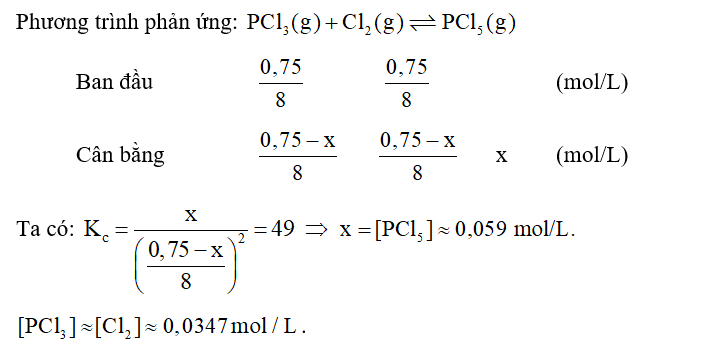
Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
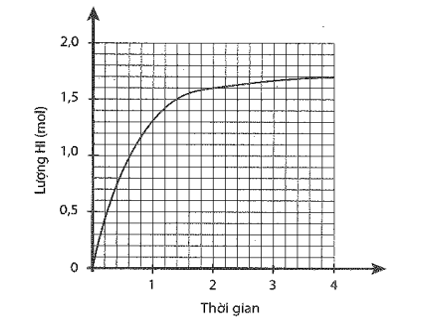
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.
Lời giải:
a) Số mol HI tại thời điểm cân bằng là 1,7 mol Số mol H2 và I2 phản ứng là 0,85 mol. Nồng độ các chất tại thời điểm cân bằng:
[H2] = [I2] = = 0,075 (mol/L)
[HI] = (mol/L)
b)
Lượng chất ban đầu : 1 1 0 (mol)
Lượng chất phản ứng: 0,85 0,85 1,7 (mol)
Nồng độ tại cân bằng: (mol/L)
Hằng số cân bằng (Kc):
c) Hiệu suất phản ứng: H%= 85%
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1.1 trang 5 SBT Hóa 11: Phản ứng nào sau đây là phản ứng thuận nghịch?...
Bài 1.3 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 1.4 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 1.5 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 1.7 trang 6 SBT Hóa 11: Cho cân bằng hoá học sau:...
Bài 1.9 trang 7 SBT Hóa 11: Cho các phản ứng hoá học sau:...
Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:...
Bài 1.15 trang 9 SBT Hóa 11: Trong dung dịch muối CoCl2 (màu hồng) tồn tại cân bằng hoá học sau:...
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hoá học