Với giải Bài 1.13 trang 8 SBT Hóa Học lớp 11 Kết nối tri thức chi tiết trong Bài 1: Khái niệm về cân bằng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa Học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 1: Khái niệm về cân bằng hóa học
Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
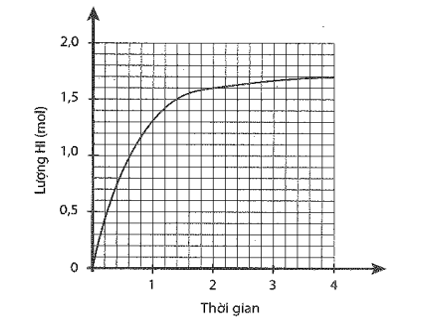
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.
Lời giải:
a) Số mol HI tại thời điểm cân bằng là 1,7 mol Số mol H2 và I2 phản ứng là 0,85 mol. Nồng độ các chất tại thời điểm cân bằng:
[H2] = [I2] = = 0,075 (mol/L)
[HI] = (mol/L)
b)
Lượng chất ban đầu : 1 1 0 (mol)
Lượng chất phản ứng: 0,85 0,85 1,7 (mol)
Nồng độ tại cân bằng: (mol/L)
Hằng số cân bằng (Kc):
c) Hiệu suất phản ứng: H%= 85%
Lý thuyết Khái niệm về cân bằng hóa học
1. Phản ứng một chiều và phản ứng thuận nghịch
a. Phản ứng một chiều
- Phản ứng một chiều là phản ứng xảy ra theo một chiều trong cùng điều kiện. Phương trình hoá học của phản ứng một chiều được biểu diễn bằng một mũi tên chỉ chiều phản ứng.
Ví dụ: NaOH + HCl → NaCl + H2O
b. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
- Phương trình hoá học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau. Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
- Trong thực tế, các phản ứng thuận nghịch xảy ra không hoàn toàn bởi vì trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Ví dụ: Cl2 + H2O ⇌ HCl + HClO
2. Cân bằng hóa học
a. Trạng thái cân bằng
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau để tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau để tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cần bằng, nồng độ các chất không thay đổi.
b. Hằng số cân bằng
* Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát aA + bB ⇌ cC + dD:
Ở trạng thái cân bằng, hằng số cân bằng (Kc) của phản ứng được xác định theo biểu thức:
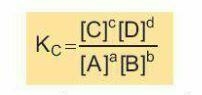
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng. a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng. Thực nghiệm cho thấy hằng số cân bằng Kc của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng. Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
* Ý nghĩa của hằng số cân bằng
Hằng số cân bằng Kc phụ thuộc vào bản chất của phản ứng và nhiệt độ. Từ biểu thức xác định hằng số cân bằng Kc, ta có thể thấy rằng: Kc càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại. Kc càng nhỏ thi phản ứng nghịch càng chiếm ưu thế hơn.
3. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
a. Ảnh hưởng của nhiệt độ
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phân ứng thu nhiệt ( Ar, Ho298> 0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại
b. Ảnh hưởng của nồng độ
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
c. Nguyên lý chuyển dịch cân bằng Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mong muốn, làm tăng hiệu suất của phản ứng
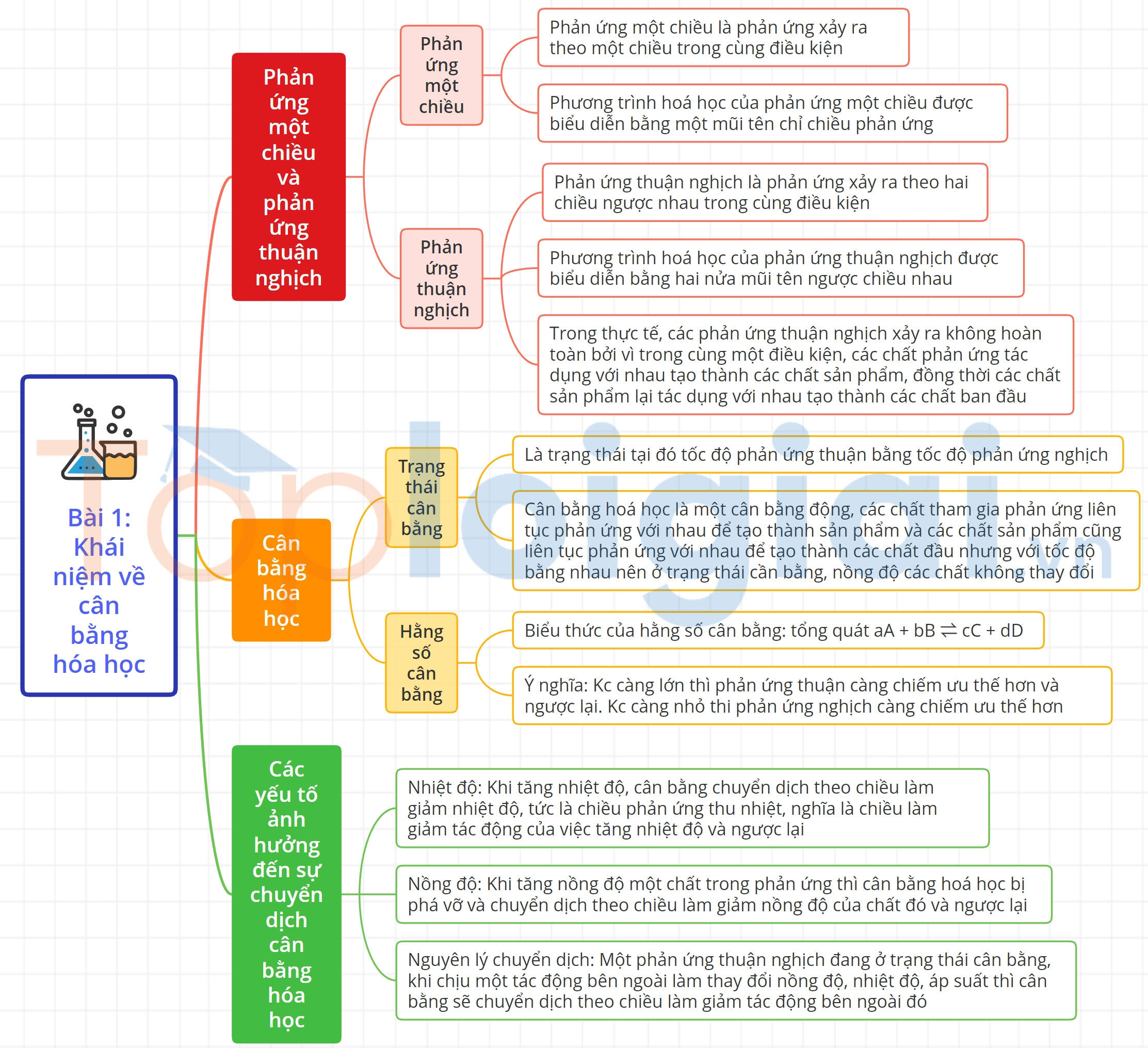
Sơ đồ tư duy Khái niệm về cân bằng hóa học
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1.1 trang 5 SBT Hóa 11: Phản ứng nào sau đây là phản ứng thuận nghịch?...
Bài 1.3 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 1.4 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 1.5 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 1.7 trang 6 SBT Hóa 11: Cho cân bằng hoá học sau:...
Bài 1.9 trang 7 SBT Hóa 11: Cho các phản ứng hoá học sau:...
Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:...
Bài 1.15 trang 9 SBT Hóa 11: Trong dung dịch muối CoCl2 (màu hồng) tồn tại cân bằng hoá học sau:...
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hoá học