Lời giải bài tập Hóa học lớp 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 14 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Giải hóa học 10 trang 88 Chân trời sáng tạo
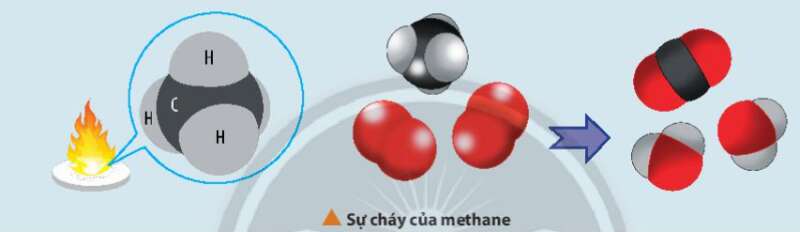
Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
Lời giải:
Biến thiên enthalpy của phản ứng được tính toán dựa trên giá trị năng lượng liên kết hoặc dựa vào enthalpy tạo thành
1. Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
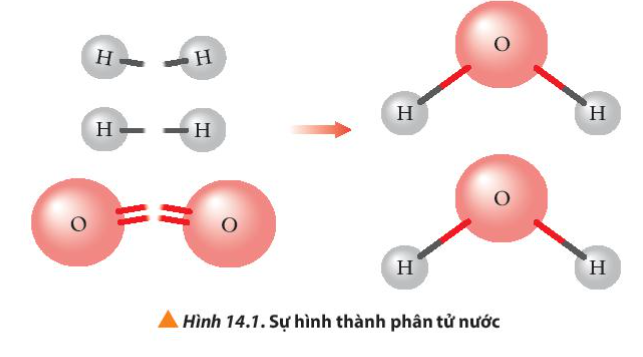
Phương pháp giải:
Quan sát Hình 14.1 và rút ra nhận xét
Lời giải:
- Khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)
+ Liên kết H-H và O=O bị phá vỡ
+ Liên kết H-O-H được hình thành
Giải hóa học 10 trang 89 Chân trời sáng tạo
Phương pháp giải:
- Viết công thức cấu tạo của các chất
=> Xác định được các loại liên kết
Lời giải:
- CH4:
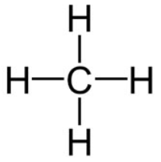
=> Có 4 liên kết C-H
- CH3Cl:
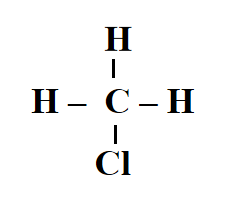
=> Có 3 liên kết C-H, 1 liên kết C-Cl
- NH3
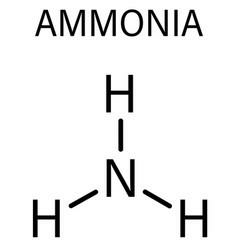
=> Có 3 liên kết N-H
- CO2
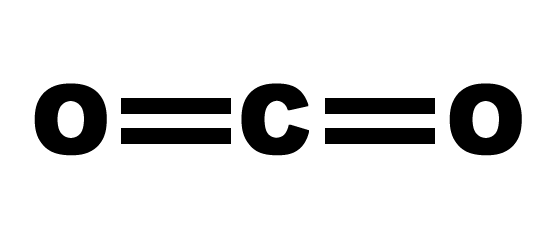
=> Có 2 liên kết C=O
N2(g) + O2(g) 2NO(g)
Phương pháp giải:
= Eb(cđ) - Eb(sp)
Lời giải:
N2(g) + O2(g) 2NO(g)
=> Phản ứng trên có 1 liên kết NN, 1 liên kết O=O và 2 liên kết N=O
Ta có:
+ N2 có 1 liên kết NN với Eb = 945 kJ/mol
+ O2 có 1 liên kết O=O với Eb = 498 kJ/mol
+ NO có 1 liên kết N=O với Eb = 607 kJ/mol
Mà: = Eb(cđ) - Eb(sp)
=> = Eb(N2) + Eb(O2) – 2Eb(NO) = 945 + 498 – 2. 607 = 229 kJ/mol > 0
=> Phản ứng thu nhiệt
=> Để phản ứng xảy ra, cần cung cấp lượng nhiệt lớn 229 kJ/mol
=> Nitrogen chỉ phản ứng với oxygen khi ở nhiệt độ cao hoặc có tia lửa điện để tạo thành NO
Luyện tập trang 89 Hóa học 10: Xác định của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
Phương pháp giải:
Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng
Bước 2: Áp dụng công thức: = Eb(cđ) - Eb(sp)
=> Phản ứng thu nhiệt hay tỏa nhiệt
Lời giải:
CH4(g) + Cl2(g) CH3Cl(g) + HCl(g)
- Chất đầu:
+ CH4 có 4 liên kết C-H
+ Cl2 có 1 liên kết Cl-Cl
- Sản phẩm
+ CH3Cl có 3 liên kết C-H, 1 liên kết C-Cl
+ HCl có 1 liên kết H-Cl
Mà: = Eb(cđ) - Eb(sp)
=> = Eb(CH4) + Eb(Cl2) – Eb(CH3Cl)- Eb(HCl)
= 4 Eb(C-H) + Eb(Cl-Cl) – 3Eb(C-H) - Eb(C-Cl) - Eb(H-Cl)
= 4.413 + 243 – 3. 413 – 339 - 427 = -110 kJ/mol < 0
=> Phản ứng tỏa nhiệt
Giải hóa học 10 trang 90 Chân trời sáng tạo
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)

Phương pháp giải:
Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng
Bước 2: Áp dụng công thức: = Eb(cđ) - Eb(sp)
Lời giải:
- Xét phản ứng: 2H2(g) + O2(g) 2H2O(g) (1)
= Eb(cđ) - Eb(sp)
=> (1) = 2Eb(H2) + Eb(O2) – 2Eb(H2O)
= 2.Eb(H-H) + Eb(O=O) – 2.2.Eb(O-H)
= 2.432 + 498 – 2.2.467 = -506 kJ/mol
- Xét phản ứng: C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
= Eb(cđ) - Eb(sp)
=> (2) = Eb(C7H16) + 11.Eb(O2) – 7.Eb(CO2) – 8.Eb(H2O)
= 6.Eb(C-C) + 16. Eb(C-H) + 11.Eb(O=O) – 7.2.Eb(C=O) – 8.2.Eb(O-H)
= 6.347 + 16.432 + 11.498 –7.2.745 - 8.2.467 = -3432 kJ/mol
Ta có: (2) < (1)
=> Phản ứng (2) xảy ra thuận lợi hơn so với phản ứng (1)
=> C7H16 là nhiên liệu hiệu quả hơn cho tên lửa
Luyện tập trang 90 Hóa học 10: Tính của hai phản ứng sau:
3O2(g) → 2O3(g) (1)
2O3(g) → 3O2(g) (2)
Liên hệ giữa giá trị với độ bền của O3, O2 và giải thích, biết phân tử O3 gồm 1 liên kết đôi O=O và 1 liên kết đơn O-O
Phương pháp giải:
Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng
Bước 2: Áp dụng công thức: = Eb(cđ) - Eb(sp)
Lời giải:
- Xét phản ứng: 3O2(g) → 2O3(g) (1)
= Eb(cđ) - Eb(sp)
=> (1) = 3. Eb(O2) – 2.Eb(O3)
= 3.Eb(O=O) – 2.(Eb(O=O) + Eb(O-O))
= 3.498 –2.(498 + 204) = 90 kJ/mol > 0
- Xét phản ứng: 2O3(g) → 3O2(g) (2)
= Eb(cđ) - Eb(sp)
=> (2) = 2.Eb(O3) - 3. Eb(O2)
= 2.(Eb(O=O) + Eb(O-O)) - 3.Eb(O=O)
= 2.(498 + 204) - 3.498 = -90 kJ/mol < 0
=> Phản ứng (1) xảy ra cần phải cung cấp năng lượng là 90 kJ/mol. Phản ứng (2) xảy ra tỏa ra năng lượng là 90 kJ/mol
=> Phản ứng (2) xảy ra thuận lợi hơn
=> Liên kết O3 bền hơn O2
Giải hóa học 10 trang 91 Chân trời sáng tạo
2. Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
4 C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói
Phương pháp giải:
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
|
Chất |
C3H5O3(NO2)3(s) |
N2(g) |
CO2(g) |
H2O(g) |
O2(g) |
|
|
-370,15 |
0 |
-393,50 |
-241,82 |
0 |
= 6.(N2) + 12.(CO2) + 10.(H2O) + (O2) - 4.(C3H5O3(NO2)3)
= 6.0 + 12.(-393,50) + 10.(-241,82) + 1.0 – 4.(-370,15)
= -5659,60 kJ < 0
=> Phản ứng phân hủy trinitroglycerin tỏa ra lượng nhiệt rất lớn => Gây tính sát thương cao
=> Trinitroglycerin được ứng dụng làm thành phần của thuốc súng không khói
Lời giải:
- Giá trị biến thiên enthalpy tỉ lệ với hệ số các chất trong phương trình
Ví dụ: 2NO2(g) → N2O4(g) có = -57,24 kJ
=> NO2(g) → ½ N2O4(g) có = -57,24 : 2 = -28,62 kJ
CS2(l) + 3O2(g) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2 2N2(g) + 6H2O(g) (2)
Phương pháp giải:
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
- Xét phản ứng: CS2(l) + 3O2(g) CO2(g) + 2SO2(g) (1)
|
Chất |
CS2(l) |
O2(g) |
CO2(g) |
SO2(g) |
|
|
+87,90 |
0 |
-393,50 |
-296,80 |
=(CO2) + 2.(SO2) - (CS2) - 3.(O2)
= (-393,50) + 2.(-296,80) – (+87,90) - 3.0
= -1075 kJ
- Xét phản ứng: 4NH3(g) + 3O2 2N2(g) + 6H2O(g) (2)
|
Chất |
NH3(g) |
O2(g) |
N2(g) |
H2O(g) |
|
|
-45,90 |
0 |
0 |
-241,82 |
= 2.(N2) + 6.(H2O) – 4.(NH3) - 3.(O2)
= 2.0 + 6.(-241,82) – 4.(-45,90) – 3.0
= -1267,32 kJ
Bài tập (trang 92,93)
Giải hóa học 10 trang 92 Chân trời sáng tạo
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
Phương pháp giải:
Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng
Bước 2: Áp dụng công thức: = Eb(cđ) - Eb(sp)
Lời giải:
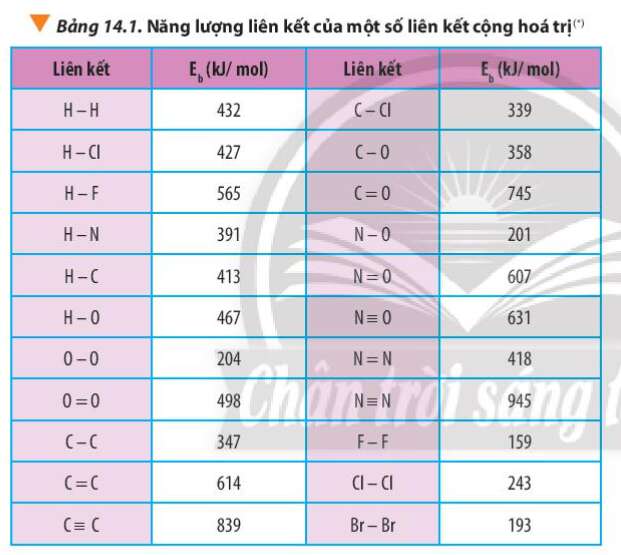
a) N2H4(g) → N2(g) + 2H2(g)
Công thức cấu tạo của N2H4:
= Eb(cđ) - Eb(sp)
=> = Eb(N2H4) – Eb(N2) – 2. Eb(H2)
= Eb(N-N) + 4.Eb(N-H) – Eb(NN) - 2.Eb(H-H)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
= Eb(cđ) - Eb(sp)
=> = 4.Eb(HCl) + Eb(O2) – 2.Eb(Cl2) – 2.Eb(H2O)
= 4.Eb(H-Cl) + Eb(O=O) – 2.Eb(Cl-Cl) - 2.2.Eb(O-H)
= 4.427 + 498 – 2.243 – 2.2.467 = -148 kJ
Phương pháp giải:
C6H6(l) + 15/2 O2(g) 6CO2(g) + 3H2O(l)
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
- Xét phản ứng: C6H6(l) + 15/2 O2(g) 6CO2(g) + 3H2O(l)
|
Chất |
C6H6(l) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
+49,00 |
0 |
-393,50 |
-285,84 |
Khi đốt cháy 1 mol C6H6(l)
= 6.(CO2) + 3.(H2O) - (C6H6) – 15/2.(O2)
= 6.(-393,50) + 3.(-285,84) – (+49,00) – 15/2.0
= -3267,52 kJ
Ta có: 1,0 g benzene = 1/78 (mol)
=> Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzene = -3267,52 . 1/78 = -41,89 kJ
- Xét phản ứng: C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
|
Chất |
C3H8(g) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
-105,00 |
0 |
-393,50 |
-285,84 |
Khi đốt cháy 1 mol C3H8(g)
= 3.(CO2) + 4.(H2O) - (C3H8) – 5.(O2)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
Ta có: 1,0 g C3H8 = 1/44 (mol)
=> Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g C3H8 = -2218,86 . 1/44 = -50,43 kJ
=> Lượng nhiệt sinh ra khi đốt cháy 1,0 g propane nhiều hơn khi đốt cháy 1,0 g benzene
Giải hóa học 10 trang 93 Chân trời sáng tạo
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị đối với phản ứng
Phương pháp giải:
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
- Xét phản ứng: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
|
Chất |
Fe(s) |
Al2O3(s) |
Al(s) |
Fe2O3(s) |
|
|
0 |
-1676,00 |
0 |
-825,50 |
= 2.(Fe) + 1.(Al2O3) – 2.(Al) - 1.(Fe2O3)
= 2.0 + 1.(-1676,00) – 2.0 – 1.(-825,50)
= -850,50 kJ < 0
Phản ứng nhiệt nhôm diễn ra sẽ sinh ra lượng nhiệt lớn là 850,50 kJ
Bài 4 trang 93 Hóa học 10: Cho phương trình nhiệt hóa học sau:
SO2(g) + ½ O2(g) SO3(g) = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3
b) Giá trị của phản ứng: SO3(g) → SO2(g) + ½ O2(g) là bao nhiêu?
Phương pháp giải:
a)
Chuyển 1 mol SO2 thành SO3 sinh ra lượng nhiệt là 98,5 kJ
Chuyển x mol SO2 thành SO3 sinh ra lượng nhiệt là y kJ
b)
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
a)
- Mol của 74,6 g SO2 = 74,6 : 64 = 373/320 (mol)
Chuyển 1 mol SO2 thành SO3 sinh ra lượng nhiệt là 98,5 kJ
Chuyển 373/320 mol SO2 thành SO3 sinh ra lượng nhiệt là y kJ
=> y = 98,5 x 373/320 = 114,81 kJ
=> Lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3 là 114,81 kJ
b)
- Xét phản ứng: SO2(g) + ½ O2(g) SO3(g)
= (sp) - (bđ)
= (SO3) - (SO2) – ½ . (O2) = -98,5 kJ
- Xét phương trình: SO3(g) → SO2(g) + ½ O2(g)
= (sp) - (bđ)
=(SO2) + ½ . (O2) - (SO3) = +98,5 kJ
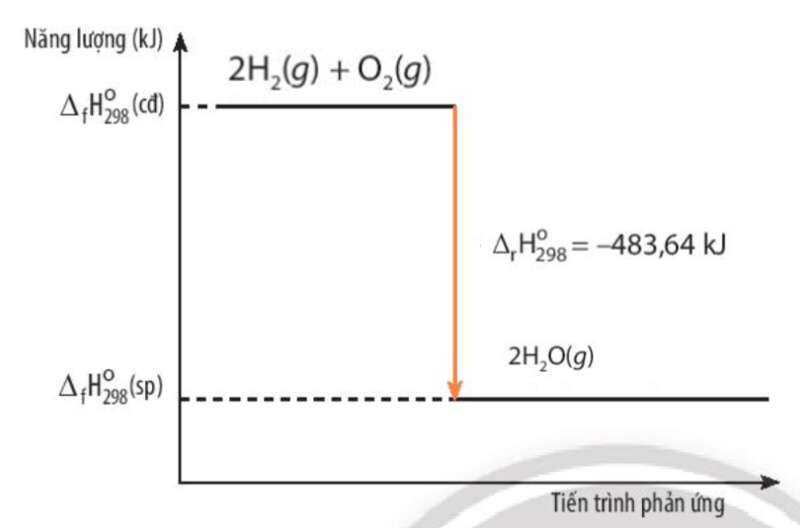
2H2(g) + O2(g) → 2H2O(g) = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen
Phương pháp giải:
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
a) Xét phản ứng: 2H2(g) + O2(g) → 2H2O(g)
= (sp) - (bđ)
= 2.(H2O) - (O2) – 2. (H2) = -483,64 kJ < 0
=> Hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn
b)
Bài 6 trang 93 Hóa học 10: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận
Phương pháp giải:
- Dựa vào nhiệt tạo thành: = (sp) - (bđ)
- Dựa vào năng lượng liên kết: = Eb(cđ) - Eb(sp)
Lời giải:
- Dựa vào nhiệt tạo thành: C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
|
Chất |
C3H8(g) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
-105,00 |
0 |
-393,50 |
-285,84 |
= (sp) - (bđ)
=> = 3.(CO2) + 4.(H2O) - (C3H8) – 5.(O2)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
- Dựa vào năng lượng liên kết: C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
= Eb(cđ) - Eb(sp)
=> = Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)
= 2.Eb(C-C) + 8.Eb(C-H) + 5.Eb(O=O) – 3.2.Eb(C=O) – 4.2.Eb(O-H)
= 2.347 + 8.413 + 5.498 – 6.745 – 8.467 = -1718 kJ
Lý thuyết Tính biến thiên enthalpy của phản ứng hóa học
I. Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
- Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hóa học của chất đầu (cđ) và hình thành các liên kết hóa học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
- Cho phản ứng tổng quát ở điều kiện chuẩn:
aA (g) + bB (g) → mM (g) + nN (g)
Tính của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
Hay tổng quát:
Với ∑Eb (cđ); ∑Eb (sp): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
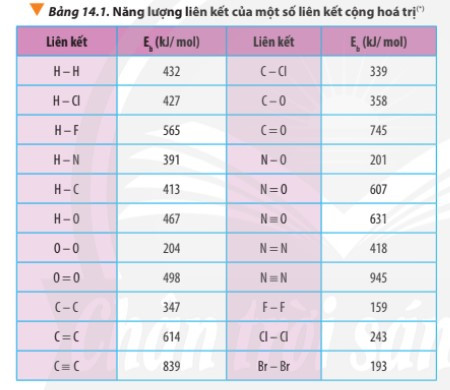
- Ví dụ: Dựa vào bảng năng lượng liên kết (phía trên) tính biến thiên enthalpy của phản ứng: 3H2(g) + N2(g) → 2NH3(g)
= 3.Eb(H2) + Eb(N2) – 2.Eb(NH3)
= 3.Eb(H-H) + Eb(N≡N) – 2.3.Eb(N-H)
= 3.432 + 945 – 2.3.391
= -105 kJ < 0 ⇒ Phản ứng tỏa nhiệt
Chú ý: Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
II. Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
- Cho phương trình hóa học tổng quát:
aA + bB → mM + nN
- Tổng quát:
Với : tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm và chất đầu của phản ứng.
- Ví dụ: Tính ∆r phản ứng đốt cháy hoàn toàn benzene C6H6(l) trong khí oxygen.
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) - ∆ f(C6H6) - ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆ r = -3267,52 kJ
Bài giảng Hóa học 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học - Chân trời sáng tạo
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA