Lời giải bài tập Hóa học lớp 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 17 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Giải hóa học 10 trang 105 Chân trời sáng tạo
Nhu cầu về nước sạch là thiết yếu và cấp bách của con người, nước sạch được dùng cho sinh hoạt, ăn uống và sản xuất. Cách xử lí nước phổ biến hiện nay là sử dụng nước chlorine hoặc các chất có chứa chlorine để khử trùng nước
Nhóm halogen gồm những nguyên tố nào? Halogen có những tính chất và ứng dụng trong lĩnh vực nào?

Lời giải:
- Nhóm halogen gồm những nguyên tố nhóm VIIA: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), astatine (At), tennessine (Ts)
- Tính chất: tác dụng với kim loại, hydrogen, dung dịch kiềm, muối halide
- Ứng dụng:
+ Fluorine: chảo chống dính, kem đánh răng
+ Chlorine: sát khuẩn, khử trùng
+ Bromine: thuốc an thần, tráng phim ảnh
+ Iodine: chống bướu cổ, chất xúc tác, dược phẩm, thuốc nhuộm
Giải hóa học 10 trang 106 Chân trời sáng tạo
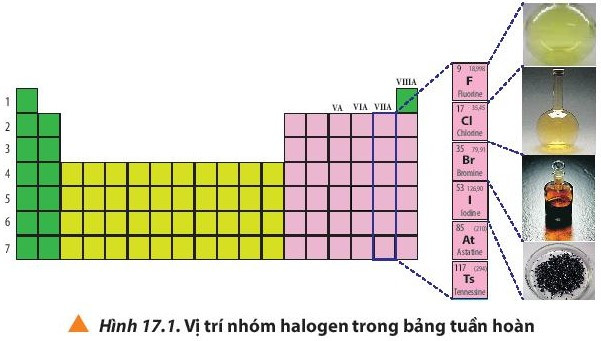
1. Vị trí của nhóm halogen trong bảng tuần hoàn
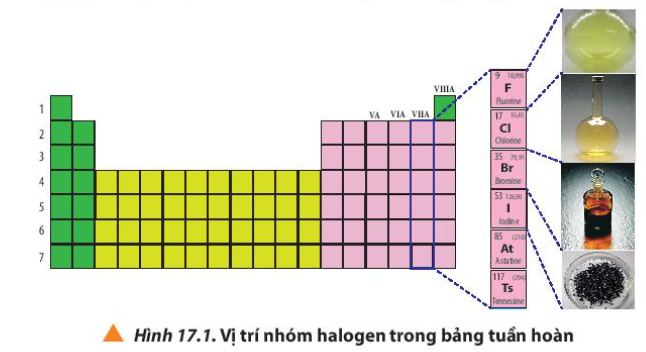
Phương pháp giải:
Quan sát Hình 17.1 và nhận xét
Lời giải:
Halogen nằm ở nhóm VIIA trong bảng tuần hoàn
2. Trạng thái tự nhiên của các halogen
Câu hỏi 2 trang 106 Hóa học 10: Hãy kể tên một số chất chứa nguyên tố halogen
Phương pháp giải:
CaF2, Ca5(PO4)3F, Na3AlF6, NaCl, KCl
Lời giải:
Một số chất chứa nguyên tố halogen
+ Fluorite: CaF2
+ Fluorapatite: Ca5(PO4)3F
+ Cryolite: Na3AlF6
+ Muối ăn: NaCl, KCl
+ Brommargyrite: AgBr
+ Iodargyrite: AgI

Phương pháp giải:
Tồn tại dưới dạng hợp chất
Lời giải:
Trong tự nhiên, các halogen không tồn tại dưới dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide
Giải hóa học 10 trang 107 Chân trời sáng tạo
Phương pháp giải:
Thành phần của biển và đại dương là muối NaCl, KCl
Lời giải:
Trên Trái Đất, 71% là biển và đại dương mà thành phần chủ yếu của nước biển là muối chloride
=> Hàm lượng nguyên tố chloride là nhiều nhất trong tự nhiên
3. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen. Đặc điểm cấu tạo phân tử halogen
Phương pháp giải:
Các nguyên tố nhóm halogen đều có 7 electron ở lớp ngoài cùng
Lời giải:
- F: (He)2s22p5
- Cl: (Ne)3s23p5
- Br: (Ar)4s24p5
- I: (Kr)5s25p5
Phương pháp giải:
- Các nguyên tố nhóm halogen có 7 electron ở lớp ngoài cùng
Lời giải:
- Các nguyên tố nhóm halogen có 7 electron ở lớp ngoài cùng
=> Có xu hướng nhận 1 electron (liên kết ion) hoặc bỏ ra 1 electron để góp chung (liên kết cộng hóa trị) để có cấu hình electron bền vững của khí hiếm
Giải hóa học 10 trang 108 Chân trời sáng tạo
4. Tính chất vật lí của các halogen
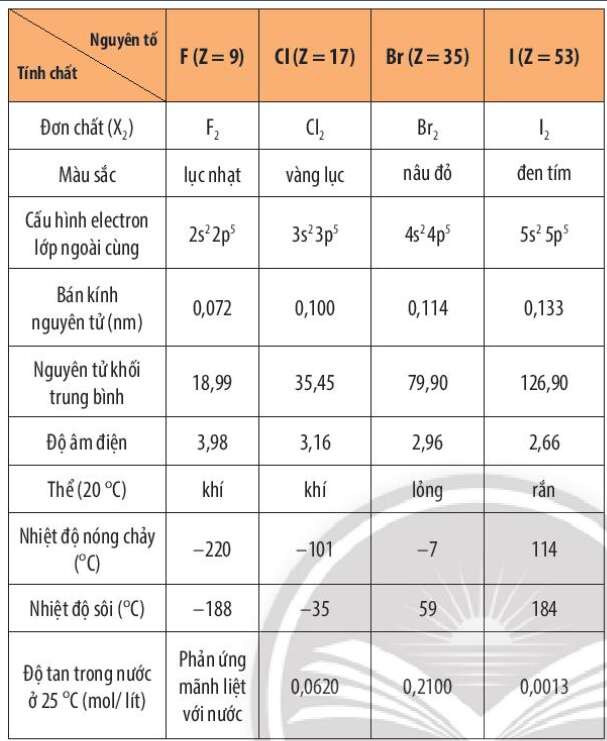
Phương pháp giải:
Quan sát Bảng 17.1 và nhận xét
Lời giải:
- Trong nhóm halogen, đi từ F đến I
+ Màu sắc: đậm dần: lục nhạt – vàng lục – nâu đỏ - đen tím
+ Thể ở điều kiện thường: khí – khí – lỏng – rắn
+ Nhiệt độ nóng chảy, nhiệt độ sôi: tăng dần
Phương pháp giải:
Phụ thuộc vào tương tác van der Waals
Lời giải:
Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng với tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng
Phương pháp giải:
Trong nhóm halogen đi từ trên xuống dưới, khối lượng phân tử và bán kính nguyên tử tăng
=> Lực tăng tác van der Waals tăng
Lời giải:
Trong nhóm halogen đi từ trên xuống dưới, khối lượng phân tử và bán kính nguyên tử tăng
=> Lực tăng tác van der Waals tăng
=> Nhiệt độ sôi tăng
=> Astatine trong điều kiện thường tồn tại ở thể rắn
Giải hóa học 10 trang 109 Chân trời sáng tạo
5. Tính chất hóa học của các halogen
Phương pháp giải:
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng
Lời giải:
- Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm
Sơ đồ: X + 1e → X-
Phương pháp giải:
Trong phản ứng với kim loại, halogen sẽ nhận 1 electron của kim loại tạo thành ion halide X-
Lời giải:
- Trong phản ứng với kim loại, các halogen từ số oxi hóa 0 sẽ nhận thêm 1 electron thành số oxi hóa -1
- Sơ đồ:
F + 1e → F-
Cl + 1e → Cl-
Br + 1e → Br-
I + 1e → I-
Giải hóa học 10 trang 110 Chân trời sáng tạo
Phương pháp giải:
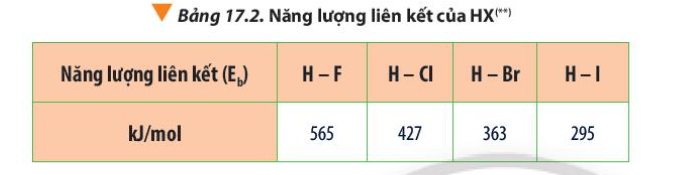
Lời giải:
- Đi từ F đến I
+ Điều kiện phản ứng với hydrogen khó dần
+ Năng lượng liên kết H-X giảm dần => Độ bền H-X giảm dần
=> Khả năng phản ứng của các halogen với hydrogen giảm dần
Phương pháp giải:
- Xác định số oxi hóa của Cl trong 2 phản ứng:
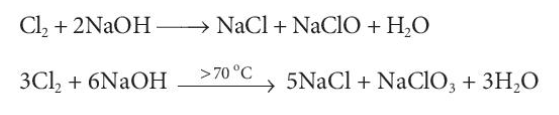
Lời giải:
- Phản ứng thứ nhất:
=> Số oxi hóa của Cl từ 0 thành -1 và +1
=> Phản ứng oxi hóa khử trong đó, Cl2 vừa là chất oxi hóa vừa là chất khử
- Phản ứng thứ 2:
=> Số oxi hóa của Cl từ 0 thành -1 và +5
=> Phản ứng oxi hóa khử trong đó, Cl2 vừa là chất oxi hóa vừa là chất khử
Giải hóa học 10 trang 111 Chân trời sáng tạo
Câu hỏi 12 trang 111 Hóa học 10: Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng
Phương pháp giải:
Tiến hành thí nghiệm và quan sát
Lời giải:
- Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt
- Ống nghiệm 2: dung dịch không màu chuyển thành vàng, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím
Phương pháp giải:
- Ống 1: Cl2 + 2NaBr → 2NaCl + Br2
- Ống 2: Br2 + 2NaI → 2NaBr + I2
Lời giải:
- Giải thích kết quả:
+ Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt của Br2
Cl2 + 2NaBr → 2NaCl + Br2
+ Ống nghiệm 2: dung dịch không màu chuyển thành vàng của I2, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím do I2 làm đổi màu hồ tinh bột
Br2 + 2NaI → 2NaBr + I2
Câu hỏi 14 trang 111 Hóa học 10: Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng
Phương pháp giải:
Tiến hành thí nghiệm và quan sát hiện tượng
Lời giải:
Hiện tượng: Giấy màu ẩm bị nhạt màu dần sau đó mất màu
Giải hóa học 10 trang 112 Chân trời sáng tạo
Phương pháp giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
Lời giải:
Sản phẩm tạo thành có khí Cl2, khí Cl2 bay lên tác dụng với H2O (giấy màu ẩm) tạo thành hỗn hợp có tính tẩy màu
Cl2 + H2O → HCl + HClO
=> Giấy màu ẩm bị nhạt màu dần sau đó mất màu
Luyện tập trang 112 Hóa học 10: Viết phương trình hóa học của các phản ứng sau:
Cu + Cl2 → (1)
Al + Br2 → (2)
Ca(OH)2 + Cl2 → (3)
KOH + Br2 (4)
Cl2 + KBr → (5)
Br2 + NaI → (6)
Lời giải:
Cu + Cl2 → CuCl2 (1)
2Al + 3Br2 → 2AlBr3 (2)
2Ca(OH)2 + 4Cl2 → CaCl2 + Ca(ClO)2 + 2H2O (3)
6KOH + 3Br2 5KBr + KBrO3 + 3H2O (4)
Cl2 + 2KBr → 2KCl + Br2 (5)
Br2 + 2NaI → 2KBr + I2 (6)
Phương pháp giải:
Tính tẩy màu: sát trùng, sát khuẩn
Lời giải:
- Tính tẩy màu của khí chlorine ẩm được ứng dụng trong lĩnh vực
+ Diệt trùng nước sinh hoạt, diệt các loại vi khuẩn gây bệnh
+ Tẩy trắng sợi, vải, giấy
Giải hóa học 10 trang 113 Chân trời sáng tạo
6. Ứng dụng của các halogen
Câu hỏi 16 trang 113 Hóa học 10: Nhận xét vai trò của halogen trong đời sống, sản xuất và y tế
Phương pháp giải:
- Fluorine, chlorine, bromine, iodine
Lời giải:
- Fluorine: dùng làm chảo chống dính, thuốc trừ sâu, chống gián và được cho vào thuốc đánh răng, tạo men răng
- Chlorine: chất tẩy trắng, khử trùng nước, sản xuất 1 số chất hữu cơ
- Bromine: thuốc an thần, thuốc trừ sâu, thuốc nhuộm, mực in, tráng phim ảnh
- Iodine: phòng bướu cổ, thiểu năng trí tuệ; ngoài ra còn dùng để sát trùng và dùng trong dược phẩm, thuốc nhuộm
=> Halogen có vai trò rất quan trọng trong đời sống, sản xuất và y tế
Câu hỏi 17 trang 113 Hóa học 10: Tìm hiểu thêm những ứng dụng khác của halogen trong thực tế
Lời giải:
- Fluorine được dùng làm chất sinh hàn trong tủ lạnh. Ngoài ra còn dùng trong công nghiệp hạt nhân để làm giàu 235U
- Hợp chất của bromine được dùng nhiều trong công nghiệp dầu mỏ, hóa chất cho nông nghiệp
Phương pháp giải:
Nước Javel có tính tẩy màu
Lời giải:
Nước Javel có tính oxi hóa mạnh, có tính tẩy màu nên có thể tẩy được vết mực trên áo trắng nhưng không nên sử dụng trên vải quần, áo màu vì nước Javel sẽ làm mất màu của quần áo đó
Bài tập (trang 113)
a) Cl2 + H2 →
b) F2 + Cu →
c) I2 + Na →
d) Cl2 + Fe →
e) Br2 + Ca(OH)2 →
f) Cl2 + KOH
g) Br2 + KI →
Lời giải:
a) Cl2 + H2 → 2HCl
b) F2 + Cu → CuF2
c) I2 + 2Na → 2NaI
d) Cl2 + Fe → FeCl3
e) Br2 + Ca(OH)2 → CaBr2 + Ca(BrO)2 + 2H2O
f) 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
g) Br2 + 2KI → 2KBr + I2
Phương pháp giải:
Các nguyên tố halogen có độ âm điện lớn
Lời giải:
Các nguyên tố halogen có độ âm điện lớn, dễ nhận 1 electron
=> Có tính oxi hóa mạnh
=> Dễ tham gia các phản ứng tạo thành hợp chất
=> Trong tự nhiên, halogen không tồn tại dạng đơn chất

a) Nồng độ chloramine B khi hòa tan vào nước đạt 0,001% có tác d ụng sát khuẩn dùng trong xử lí nước sinh hoạt. Cần dùng bao nhiêu viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước?
b) Chloramine B nồng độ 2% dùng để xịt trên các bề mặt vật dụng nhằm sát khuẩn, virus gây bệnh. Để pha chế dung dịch này, sử dụng chloramine B 25% dạng bột, vậy cần bao nhiêu gam bột chloramine B 25% pha với 1 lít nước để được dung dịch sát khuẩn 2%
Lời giải:
a) 200 lít nước ⇔ 200 000 g nước
250 mg = 0,25 g
Đặt x là số viên nén chloramine B 25% (loại viên 1 gam)
⇒ m chất tan = 0,25x (gam)
Áp dụng công thức tính nồng độ phần trăm:
⇔
⇔ x = 8
Vậy cần dùng 8 viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước.
b) 1 lít nước ⇔ 1 kg nước = 1000 g nước.
Đặt y là khối lượng chloramine B 25% dạng bột cần dùng
⇒ m chất tan = 0,25.y (gam)
Áp dụng công thức tính nồng độ phần trăm:
⇔
⇔ y = 81,6 gam
Vậy cần dử dụng 81,6 gam chloramine B 25% dạng bột pha với 1 lít nước để được dung dịch sát khuẩn 2%.
Lý thuyết Tính chất vật lí và hóa học các đơn chất nhóm VIIA
I. Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts).
- Trong đó astatine (At) và tennessine (Ts) là các nguyên tố phóng xạ.
II. Trạng thái tự nhiên của các halogen
- Halogen trong tự nhiên không tồn tại ở dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F-, Cl-, Br-, I-).
|
Nguyên tố |
Một số dạng tồn tại trong tự nhiên |
|
Fluoride |
Fluorite (CaF2); fluorapatite (Ca5(PO4)3F) và cryolite (Na3AlF6). |
|
Chloride |
Nước biển, trong quặng halite (NaCl, thường gọi là muối mỏ), sylvite (KCl). |
|
Bromide |
Quặng bromargyrite (AgBr), nước biển, mỏ muối. |
|
Iodide |
Iodargyrite (AgI), nước biển, mỏ muối. |

III. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen. Đặc điểm cấu tạo phân tử halogen
- Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron: phân lớp s có 2 electron, phân lớp p có 5 electron.
- Để đạt cấu hình electron bền vững giống khí hiếm, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử.
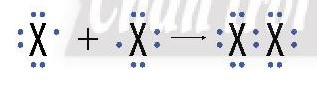
+ Với X là kí hiệu các nguyên tố halogen.
+ Công thức cấu tạo của phân tử halogen: X – X.
Kết luận: Đơn chất halogen tồn tại ở dạng phân tử X2, liên kết trong phân tử là liên kết cộng hóa trị không phân cực.
IV. Tính chất vật lý của các halogen
- Các halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4), …
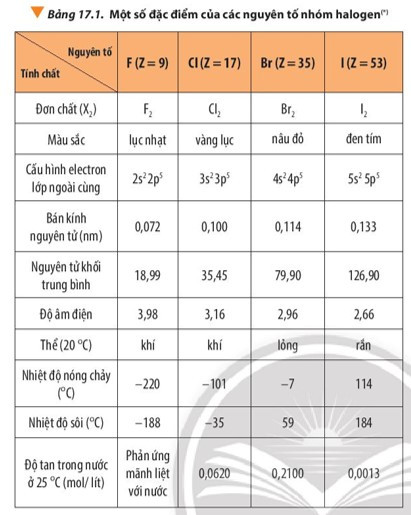
- Từ fluorine đến iodine:
+ Trạng thái tập hợp của đơn chất ở 20oC thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn.
+ Màu sắc đậm dần: fluorine có màu lục nhạt, chlorine có màu vàng lục, bromine có màu nâu đỏ, iodine có màu đen tím.
+ Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi tăng.
V. Tính chất hóa học của các halogen
- Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng.
Sơ đồ tổng quát: X + 1e → X-
- Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
1. Tác dụng với kim loại
- Các halogen phản ứng với kim loại thể hiện các mức độ khác nhau:
+ Fluorine tác dụng được với tất các các kim loại, ví dụ:
2Ag + F2 → 2AgF
+ Chlorine tác dụng với hầu hết các kim loại trừ Au, Pt. Ví dụ:
2Fe + 3Cl2 → 2FeCl3
+ Bromine phản ứng với nhiều kim loại, nhưng khả năng phản ứng yếu so với fluorine và chlorine. Ví dụ:
2Na + Br2 → 2NaBr
+ Iodine phản ứng với kim loại yếu hơn so với bromine, chlorine và fluorine. Ví dụ:
2Al + 3I2 2AlI3

2. Tác dụng với hydrogen
- Khi tác dụng với hydrogen, fluorine phản ứng nổ mạnh ngay cả trong bóng tối, nhiệt độ rất thấp (-252oC)
H2 + F2 → 2HF
- Chlorine phản ứng trong điều kiện chiếu sáng hoặc đun nóng
H2 + Cl2 2HCl
- Bromine phản ứng khi đun nóng 200 – 400oC
H2 + Br2 2HBr
- Iodine phản ứng khó khăn hơn, cần đun nóng 350 – 500oC, chất xúc tác Pt và phản ứng xảy ra thuận nghịch.
H2 + I2 2HI

Mở rộng:
+ Fluorine phản ứng mạnh với nước, bốc cháy trong hơi nước nóng.
2F2 + 2H2O → 4HF + O2↑
+ Chlorine và bromine tác dụng chậm với nước tạo thành hydrohalic acid và hypohalous acid, khả năng phản ứng của bromine khó khăn hơn.
Cl2 + H2O ⇄ HCl + HClO
Br2 + H2O ⇄ HBr + HBrO
+ Iodine phản ứng rất chậm với nước tạo iodic acid
3I2 + 3H2O ⇄ 5HI + HIO3
3. Tác dụng với dung dịch kiềm
- Halogen tác dụng với dung dịch kiềm, sản phẩm tạo thành phụ thuộc vào nhiệt độ phản ứng.
- Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O
Chú ý:
+ Hỗn hợp dung dịch NaCl và NaClO được gọi là nước Javel, có tính oxi hóa mạnh nên được dùng làm chất tẩy màu và sát trùng.
+ Phản ứng của chlorine với dung dịch kiềm được dùng để sản xuất các chất tẩy rửa, sát trùng, tẩy trắng trong ngành dệt, da, bột giấy, …
4. Tác dụng với dung dịch muối halide
- Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
5. Tính tẩy màu của khí chlorine ẩm
Cl2 + H2O ⇄ HCl + HClO
- Phản ứng giữa chlorine và nước là thuận nghịch nên tạo ra dung dịch gồm nước, hydrochloric acid (HCl); hypoclorous acid (HClO) cùng chlorine.
- Hypoclorous acid (HClO) có tính oxi hóa mạnh có thể phá hủy các hợp chất màu nên khí chlorine ẩm có tính tẩy màu.
- Tính tẩy màu của khí chlorine ẩm được ứng dụng:
+ Tẩy trắng sợi, vải, giấy.
+ Sản xuất chất tẩy rửa.
+ Tiệt trùng nước sinh hoạt, nước trong các bể bơi.
VI. Ứng dụng của các halogen
- Fluorine: Được dùng trong sản xuất các chất dẻo ma sát thấp, như teflon phủ trên chảo chống dính… Một số hợp chất khác của fluorine như cryolite dùng cho sản xuất nhôm; sodium fluorine sử dụng như một loại thuốc trừ sâu, chống gián; một số muối fluorine khác được thêm vào thuốc đánh răng, tạo men răng, …

- Chlorine: Là chất oxi hóa mạnh, được sử dụng làm chất tẩy trắng và khử trùng nước. Một lượng lớn chlorine được dùng để sản xuất các dung môi như carbon tetrachloride (CCl4), chloroform (CHCl3) …

- Bromine: Được dùng để điều chế thuốc an thần, thuốc trừ sâu, thuốc nhuộm, mực in; silver bromide (AgBr) là chất nhạy với ánh sáng, dùng để tráng phim ảnh, phụ gia chống ăn mòn cho xăng, …

- Iodine: Là nguyên tố vi lượng cần thiết cho dinh dưỡng của con người, thiếu iodine có thể gây nên tác hại cho sức khỏe như gây bệnh bướu cổ, thiểu năng trí tuệ, hỗn hợp ethanol và iodine là chất sát trùng phổ biến. Các hợp chất iodine được sử dụng làm chất xúc tác, dược phẩm và thuốc nhuộm.
Bài giảng Hóa học 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA - Chân trời sáng tạo
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 18: Hydrogen halide và một số phản ứng của ion halide