Với Giải hóa học lớp 10 trang 93 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 93 Chân trời sáng tạo
Bài 3 trang 93 Hóa học 10: Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị đối với phản ứng
Phương pháp giải:
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
- Xét phản ứng: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
|
Chất |
Fe(s) |
Al2O3(s) |
Al(s) |
Fe2O3(s) |
|
|
0 |
-1676,00 |
0 |
-825,50 |
= 2.(Fe) + 1.(Al2O3) – 2.(Al) - 1.(Fe2O3)
= 2.0 + 1.(-1676,00) – 2.0 – 1.(-825,50)
= -850,50 kJ < 0
Phản ứng nhiệt nhôm diễn ra sẽ sinh ra lượng nhiệt lớn là 850,50 kJ
Bài 4 trang 93 Hóa học 10: Cho phương trình nhiệt hóa học sau:
SO2(g) + ½ O2(g) SO3(g) = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3
b) Giá trị của phản ứng: SO3(g) → SO2(g) + ½ O2(g) là bao nhiêu?
Phương pháp giải:
a)
Chuyển 1 mol SO2 thành SO3 sinh ra lượng nhiệt là 98,5 kJ
Chuyển x mol SO2 thành SO3 sinh ra lượng nhiệt là y kJ
b)
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
a)
- Mol của 74,6 g SO2 = 74,6 : 64 = 373/320 (mol)
Chuyển 1 mol SO2 thành SO3 sinh ra lượng nhiệt là 98,5 kJ
Chuyển 373/320 mol SO2 thành SO3 sinh ra lượng nhiệt là y kJ
=> y = 98,5 x 373/320 = 114,81 kJ
=> Lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3 là 114,81 kJ
b)
- Xét phản ứng: SO2(g) + ½ O2(g) SO3(g)
= (sp) - (bđ)
= (SO3) - (SO2) – ½ . (O2) = -98,5 kJ
- Xét phương trình: SO3(g) → SO2(g) + ½ O2(g)
= (sp) - (bđ)
=(SO2) + ½ . (O2) - (SO3) = +98,5 kJ
Bài 5 trang 93 Hóa học 10: Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau:
2H2(g) + O2(g) → 2H2O(g) = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen
Phương pháp giải:
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
a) Xét phản ứng: 2H2(g) + O2(g) → 2H2O(g)
= (sp) - (bđ)
= 2.(H2O) - (O2) – 2. (H2) = -483,64 kJ < 0
=> Hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn
b)
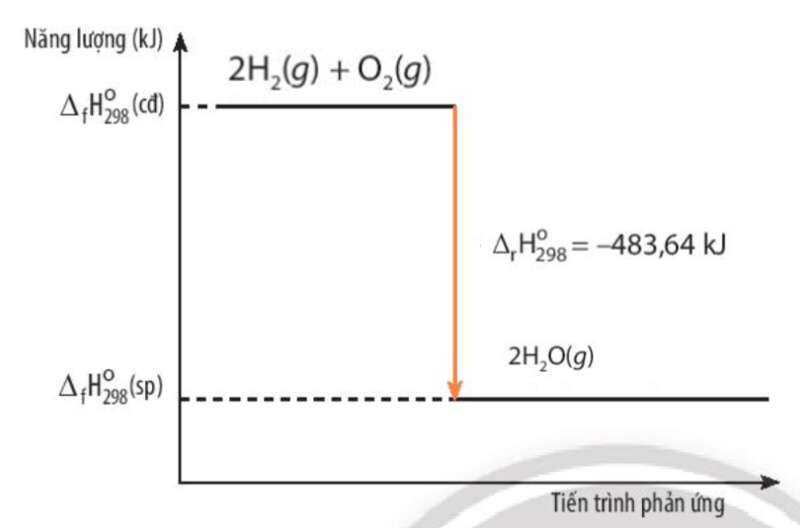
Bài 6 trang 93 Hóa học 10: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận
Phương pháp giải:
- Dựa vào nhiệt tạo thành: = (sp) - (bđ)
- Dựa vào năng lượng liên kết: = Eb(cđ) - Eb(sp)
Lời giải:
- Dựa vào nhiệt tạo thành: C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
|
Chất |
C3H8(g) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
-105,00 |
0 |
-393,50 |
-285,84 |
= (sp) - (bđ)
=> = 3.(CO2) + 4.(H2O) - (C3H8) – 5.(O2)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
- Dựa vào năng lượng liên kết: C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
= Eb(cđ) - Eb(sp)
=> = Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)
= 2.Eb(C-C) + 8.Eb(C-H) + 5.Eb(O=O) – 3.2.Eb(C=O) – 4.2.Eb(O-H)
= 2.347 + 8.413 + 5.498 – 6.745 – 8.467 = -1718 kJ
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: