Lời giải bài tập Hóa học lớp 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 15 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Giải hóa học 10 trang 94 Chân trời sáng tạo

Lời giải:
- Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học, người ta dùng đại lượng: tốc độ phản ứng
- Cách tính: Cho phản ứng tổng quát:
aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
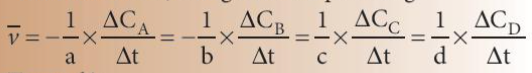
Trong đó:
: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2
1. Tốc độ phản ứng

Lời giải:
- Trong đám cháy của lá cây khô: Phản ứng hóa học xảy ra nhanh. Các lá cây nhanh chóng bị cháy và chuyển thành tro
- Thân tàu biển bị oxi hóa trong điều kiện tự nhiên: Phản ứng hóa học xảy ra chậm. Vỏ tàu biển làm bằng thép mất thời gian rất lâu mới bị gỉ (bị oxi hóa)
Giải hóa học 10 trang 95 Chân trời sáng tạo
Lời giải:
- Ví dụ: Đốt cháy
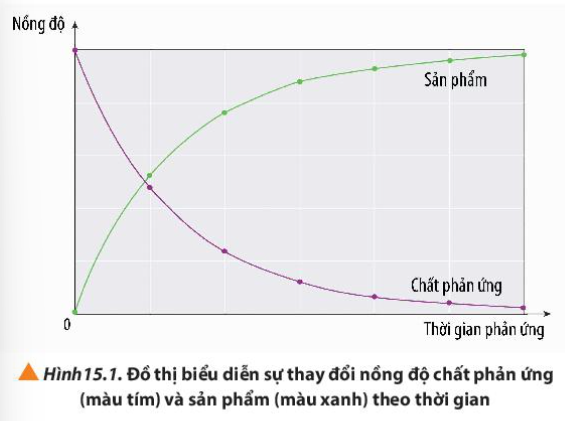
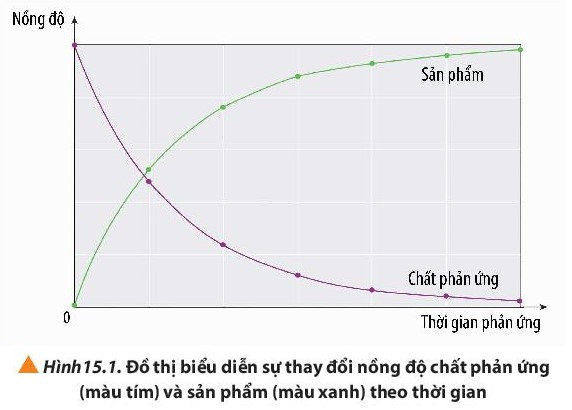
Phương pháp giải:
Quan sát đồ thị và rút ra nhận xét
Lời giải:
- Nồng độ chất phản ứng giảm dần theo thời gian
- Nồng độ chất sản phẩm tăng dần theo thời gian
Luyện tập trang 95 Hóa học 10: Xét phản ứng phân hủy N2O5 ở 45oC
N2O5(g) → N2O4(g) + ½ O2(g)
Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tính tốc độ trung bình của phản ứng theo N2O4 trong khoảng thời gian trên
Phương pháp giải:
aA + bB → cC + dD
Áp dụng công thức:
Lời giải:
Áp dụng công thức:
=>
Tốc độ trung bình của phản ứng theo N2O4 trong 184 giây là 1,36.10-3 (M/s)
Giải hóa học 10 trang 96 Chân trời sáng tạo
2. Biểu thức tốc độ phản ứng
Phương pháp giải:
Định luật tác dụng khối lượng: Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp
Lời giải:
Tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia phản ứng với số mũ thích hợp
=> Khi nồng độ tăng thì tốc độ phản ứng tăng và ngược lại
Phương pháp giải:
Ví dụ:
+ Que đóm còn tàn đỏ bùng cháy khi cho vào bình oxygen
+ Cho nhiều men vào bánh mì thì bánh mì lên men nhanh hơn
+ Làm sữa chua
Lời giải:
- Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì k hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn
- Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn
- Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
Luyện tập trang 96 Hóa học 10: Cho phản ứng đơn giản sau:
H2(g) + Cl2(g) → 2HCl(g)
a) Viết biểu thức tốc độ tức thời của phản ứng trên
b) Tốc độ phản ứng thay đổi thế nào khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2?
Phương pháp giải:
a) v = k.CCl2.CH2
b) Áp dụng công thức tính tốc độ tức thời
Lời giải:
a) Biểu thức tốc độ tức thời của phản ứng là:
v1 = k.CCl2.CH2
b) Gọi CCl2 là nồng độ ban đầu của Cl, CH2 là nồng độ đầu của H2
=> v2 = k. CCl2.CH2 :2
=> 2v2 = v1
=> Tốc độ phản ứng giảm 1 nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2
|
Nướng bánh mì |
(1) |
|
Đốt gas khi nấu ăn |
(2) |
|
Lên men sữa tạo ra sữa chua |
(3) |
|
Tấm tôn thiếc bị gỉ sét |
(4) |
Lời giải:
Sắp xếp theo thứ tự tốc độ giảm dần:
|
Đốt gas khi nấu ăn: vài giây |
(2) |
|
Nướng bánh mì: 2-3 phút |
(1) |
|
Lên men sữa tạo ra sữa chua: 1 ngày |
(3) |
|
Tấm tôn thiếc bị gỉ sét: 1 tháng |
(4) |
Giải hóa học 10 trang 97 Chân trời sáng tạo
Bài tập (trang 97)
Bài 1 trang 97 Hóa học 10: Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g)
a) Viết biểu thức tốc độ tức thời của phản ứng
b) Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi
- nồng độ O2 tăng 3 lần, nồng độ NO không đổi?
- nồng độ NO tăng 3 lần, nồng độ O2 không đổi?
- nồng độ NO và O2 đều tăng 3 lần?
Phương pháp giải:
a) v = k.CNO2.CO2
b) Áp dụng công thức tính tốc độ tức thời
Lời giải:
a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2
b)
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3)
=> v2 tăng 3 lần so với v1
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2
=> v3 tăng 9 lần so với v1
- Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2
=> v4 tăng 27 lần so với v1
2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
Lời giải:
Từ phương trình hóa học nhận thấy: hệ số cân bằng của NO là 2, hệ số cân bằng của N2 là 1
=> Trong cùng thời gian, nồng độ tiêu hao của NO nhanh gấp 2 lần nồng độ tạo thành của N2
Bài 3 trang 97 Hóa học 10: Cho phản ứng:
2N2O5(g) → 4NO2(g) + O2(g)
Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30M lên 0,40M. Tính tốc độ trung bình của phản ứng
Phương pháp giải:
Áp dụng công thức:
Lời giải:
Vì NO2 là chất sản phẩm
=>

a) Tính tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
b) Sau 100 phút, nồng độ của SO2Cl2 còn lại là bao nhiêu
c) Sau 200 phút, nồng độ của SO2 và Cl2 thu được là bao nhiêu?
Phương pháp giải:
Áp dụng công thức:
Lời giải:
a) Trong 100 phút, chất tạo thành từ 0M tăng lên 0,13M
=> ∆C = 0,13M
b) Ta có: -∆CSO2Cl2 = 0,13M = 1,00 – C2
=> C2 = 0,87M
c) Sau 200 phút
-∆CSO2Cl2 = C1 – C2 = 1,00 – 0,78 = 0,22M
=> Sau 200 phút, nồng độ của SO2 và Cl2 = 0,22M
Lý thuyết Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
I. Tốc độ phản ứng
1. Khái niệm tốc độ phản ứng hóa học
- Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian).
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
- Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó
2. Tính tốc độ trung bình của phản ứng hóa học
Cho phản ứng tổng quát: aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
Trong đó:
: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1 và t2.
Ví dụ: Trong phản ứng hóa học: N2O5(g) → N2O4(g) + O2(g)
Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tốc độ trung bình của phản ứng theo nồng độ N2O4 trong khoảng thời gian trên là:
= 1,36.10-3 (M/s)
II. Biểu thức tốc độ phản ứng
- Năm 1864, hai nhà bác học Guldberg và Waage khi nghiên cứu sự phụ thuộc của tốc độ vào nồng độ đã đưa ra định luật tác dụng khối lượng: Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
- Biểu thức tốc độ phản ứng:
Xét phản ứng đơn giản có dạng: aA + bB → cC + dD
+ Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức:
+ Trong đó:
k là hằng số tốc độ phản ứng;
CA; CB là nồng độ (M) chất A, B tại thời điểm đang xét.
Chú ý:
+ Khi nồng độ chất phản ứng bằng đơn vị (1M) thì k = v, vậy k là tốc độ phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng.
+ Hằng số k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ.
+ Định luật tác dụng khối lượng chỉ đúng cho các phản ứng đơn giản, đó là phản ứng một chiều, chỉ qua một giai đoạn từ chất phản ứng tạo ra sản phẩm.
Ví dụ: Xét phản ứng: H2(g) + Cl2(g) → 2HCl(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật là:
Bài giảng Hóa học 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng - Chân trời sáng tạo
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 18: Hydrogen halide và một số phản ứng của ion halide