Với Giải hóa học lớp 10 trang 92 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 92 Chân trời sáng tạo
Bài 1 trang 92 Hóa học 10: Tính của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
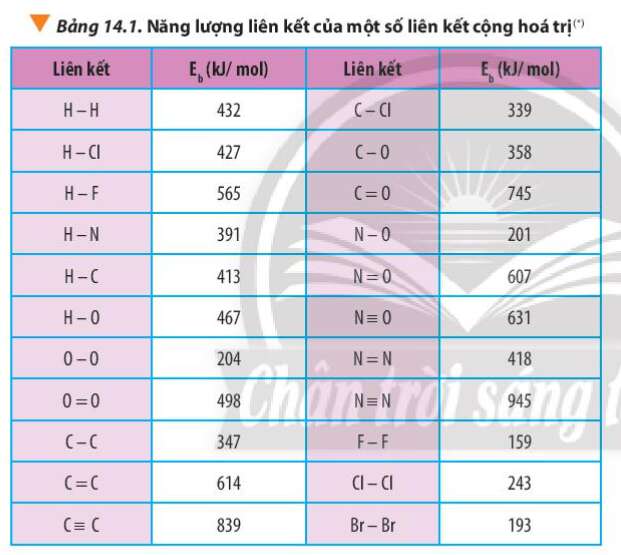
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
Phương pháp giải:
Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng
Bước 2: Áp dụng công thức: = Eb(cđ) - Eb(sp)
Lời giải:
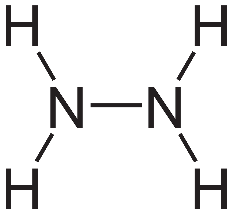
a) N2H4(g) → N2(g) + 2H2(g)
Công thức cấu tạo của N2H4:
= Eb(cđ) - Eb(sp)
=> = Eb(N2H4) – Eb(N2) – 2. Eb(H2)
= Eb(N-N) + 4.Eb(N-H) – Eb(NN) - 2.Eb(H-H)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
= Eb(cđ) - Eb(sp)
=> = 4.Eb(HCl) + Eb(O2) – 2.Eb(Cl2) – 2.Eb(H2O)
= 4.Eb(H-Cl) + Eb(O=O) – 2.Eb(Cl-Cl) - 2.2.Eb(O-H)
= 4.427 + 498 – 2.243 – 2.2.467 = -148 kJ
Bài 2 trang 92 Hóa học 10: Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Phương pháp giải:
C6H6(l) + 15/2 O2(g) 6CO2(g) + 3H2O(l)
Áp dụng công thức: = (sp) - (bđ)
Lời giải:
- Xét phản ứng: C6H6(l) + 15/2 O2(g) 6CO2(g) + 3H2O(l)
|
Chất |
C6H6(l) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
+49,00 |
0 |
-393,50 |
-285,84 |
Khi đốt cháy 1 mol C6H6(l)
= 6.(CO2) + 3.(H2O) - (C6H6) – 15/2.(O2)
= 6.(-393,50) + 3.(-285,84) – (+49,00) – 15/2.0
= -3267,52 kJ
Ta có: 1,0 g benzene = 1/78 (mol)
=> Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzene = -3267,52 . 1/78 = -41,89 kJ
- Xét phản ứng: C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
|
Chất |
C3H8(g) |
O2(g) |
CO2(g) |
H2O(l) |
|
|
-105,00 |
0 |
-393,50 |
-285,84 |
Khi đốt cháy 1 mol C3H8(g)
= 3.(CO2) + 4.(H2O) - (C3H8) – 5.(O2)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
Ta có: 1,0 g C3H8 = 1/44 (mol)
=> Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g C3H8 = -2218,86 . 1/44 = -50,43 kJ
=> Lượng nhiệt sinh ra khi đốt cháy 1,0 g propane nhiều hơn khi đốt cháy 1,0 g benzene
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: