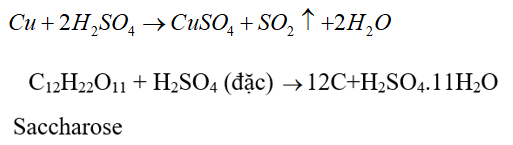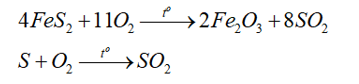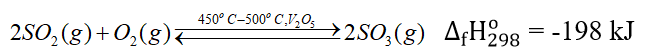Với giải Câu hỏi thảo luận 2 trang 41 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 7: Sulfuric acid và muối sulfate giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 7: Sulfuric acid và muối sulfate
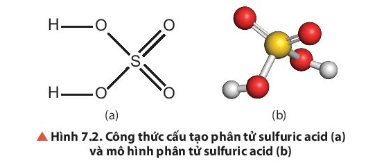
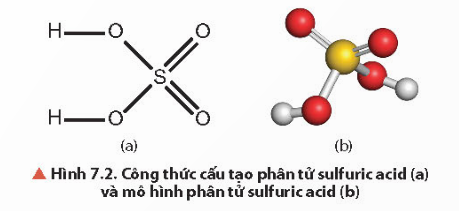
Câu hỏi thảo luận 2 trang 41 Hóa học 11: Quan sát Hình 7.2, mô tả cấu tạo phân tử của H2SO4.
Lời giải:
- Liên kết trong phân tử H2SO4 là liên kết cộng hoá trị.
- Phân tử H2SO4 có 2 nguyên tử hydrogen linh động, nguyên tử sulfur tạo được 6 liên kết cộng hoá trị với các nguyên tử oxygen.
Lý thuyết Sulfuric acid
a) Tính chất vật lý và cấu tạo phân tử:
- Là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84g/cm3).
- Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O.
b) Tính chất hóa học và ứng dụng
- Dung dịch H2SO4 loãng có tính chất chung của acid như:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với basic oxide và base
+ Tác dụng với muối
-Dung dịch H2SO4 đặc, nóng có tính oxi hóa mạnh và tính háo nước
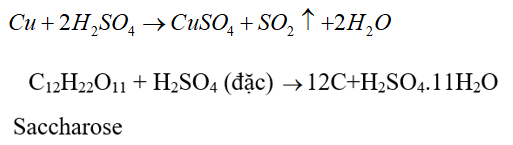
- Ứng dụng
+ Sulfuric acid đặc hấp thụ mạnh hơi nước nên được dùng để làm khô những khí không tác dụng với nó.
+ Dùng để sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo…
c) Cách bảo quản, sử dụng và nguyên tắc xử lí khi bỏng acid
- Khi sử dụng, bảo quản dung dịch sulfuric acid cần phải cẩn thận, tuân thủ đúng nguyên tắc an toàn.
- Cách pha loãng dung dịch H2SO4 đặc: đổ từ từ dung dịch H2SO4 đặc vào nước, tuyệt đối không làm ngược lại.
- Khi bị bỏng acid cần nhanh chóng bỏ quần áo bị dính acid, rửa ngay bằng nước sạch khoảng 20 phút sau đó đến cơ sở ý tế gần nhất.
d) Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
- Giai đoạn 1: Sản xuất SO2:
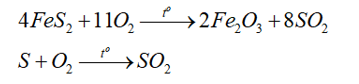
- Giai đoạn 2: Sản xuất SO3
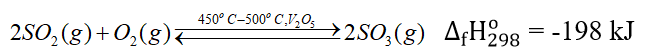
- Giai đoạn 3: Sản xuất H2SO4
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 40 Hóa học 11: Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Sản lượng sulfuric acid của một quốc gia là một trong những chỉ số đánh giá sức mạnh công nghiệp hoá chất của quốc gia đó. Sulfuric acid có những tính chất và ứng dụng gì trong đời sống?...
Câu hỏi thảo luận 1 trang 40 Hóa học 11: Quan sát Hình 7.1 nhận xét màu, trạng thái của sulfuric acid ở điều kiện thường và cho biết tại sao sulfuric acid lại không bay hơi....
Câu hỏi thảo luận 2 trang 41 Hóa học 11: Quan sát Hình 7.2, mô tả cấu tạo phân tử của H2SO4....
Câu hỏi thảo luận 3 trang 41 Hóa học 11: Quan sát Hình 7.3, nêu hiện tượng, viết phương trình hoá học xảy ra (nếu có)....
Câu hỏi thảo luận 4 trang 41 Hóa học 11: Viết quá trình oxi hoá và quá trình khử trong phản ứng của dung dịch H2SO4 đặc với Cu ở Thí nghiệm 1....
Câu hỏi thảo luận 5 trang 41 Hóa học 11: Giải thích hiện tượng xảy ra trong Thí nghiệm 2....
Luyện tập trang 42 Hóa học 11: Viết phương trình hoá học khi cho dung dịch H2SO4 đặc tác dụng với KBr, C. Cho biết sản phẩm khử duy nhất là SO2....
Câu hỏi thảo luận 6 trang 43 Hóa học 11: Quan sát Hình 7.5, mô tả cách pha loãng sulfuric acid. Giải thích....
Câu hỏi thảo luận 7 trang 43 Hóa học 11: Hãy nêu nguyên tắc chung trong việc xử lí sơ bộ khi bỏng acid....
Câu hỏi thảo luận 8 trang 43 Hóa học 11: Hãy giải thích vì sao ở giai đoạn tạo ra SO3, người ta chọn điều kiện phản ứng ở nhiệt độ cao (450 oC – 500 oC)....
Vận dụng trang 43 Hóa học 11: Hãy cho biết giai đoạn nào trong quá trình sản xuất H2SO4 có nguy cơ cao gây ô nhiễm môi trường. Giải thích....
Câu hỏi thảo luận 9 trang 44 Hóa học 11: Nêu ứng dụng trong đời sống, sản xuất của một số muối sulfate mà em biết....
Câu hỏi thảo luận 10 trang 44 Hóa học 11: Quan sát Hình 7.6, trình bày cách nhận biết ion SO42-. Nêu hiện tượng xảy ra, viết phương trình hoá học....
Bài 1 trang 45 Hóa học 11: Tính chất nào sau đây không phải là tính chất của dung dịch sulfuric acid đặc?...
Bài 2 trang 45 Hóa học 11: Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?...
Bài 3 trang 45 Hóa học 11: Dung dịch sulfuric acid đặc được dùng làm khô khí nào trong số các khí sau: CO, H2, CO2, SO2, O2 và NH3. Giải thích.....
Bài 4 trang 45 Hóa học 11: Cho các dung dịch không màu của mỗi chất sau: K2CO3, Na2SO4, Ba(NO3)2. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra...
Bài 5 trang 45 Hóa học 11: Có 4 mẫu sau: dung dịch NaOH, dung dịch HCl, dung dịch H2SO4 và H2O được kí hiệu bằng các chữ cái A, B, C và D (không theo trình tự trên). Kết quả của những thí nghiệm nhận biết những mẫu này được ghi trong bảng sau:...
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: