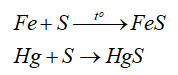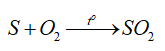Với giải Câu hỏi thảo luận 5 trang 37 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 6: Sulfur và sulfur dioxide giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 6: Sulfur và sulfur dioxide
Câu hỏi thảo luận 5 trang 37 Hóa học 11: Nêu hiện tượng xảy ra và xác định vai trò của S, O2 trong phương trình hoá học của phản ứng ở Thí nghiệm 2.
Lời giải:
Hiện tượng: Sulfur cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong không khí mãnh liệt hơn.
Phương trình hoá học:
Chất khử: S; chất oxi hoá: O2.
Lý thuyết Đơn chất Sulfur
a) Trạng thái tự nhiên:
- Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét.
- Khoáng vật trong tự nhiên chứa sulfur ở dạng hợp chất: quặng pyrite (FeS2), quặng gypsum (CaSO4.2H2O), quặng galena (PbS), quặng barite (BaSO4).
b) Cấu tạo, tính chất vật lý cơ bản của sulfur đơn chất
- Ở dạng phân tử, 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng. Kí hiệu là S.
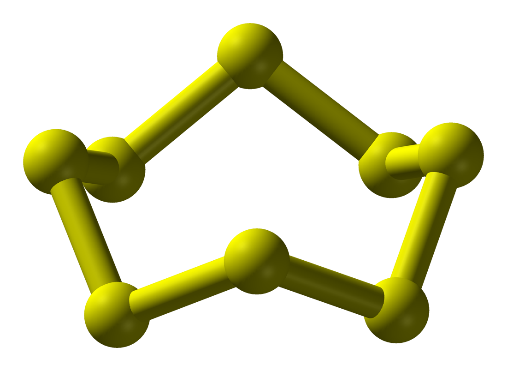
Hình 1: Phân tử sulfur ở điều kiện thường
-Ở điều kiện thường sulfur là: chất rắn, màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ (benzine, carbon disulfide,…)
c) Tính chất hóa học
- Tính oxi hóa: sulfur oxi hóa được nhiều kim loại (trừ Au, Pt, Ag) ở nhiệt độ cao -> Muối sulfide
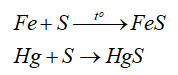
-Tính khử:
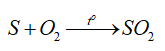
d) Ứng dụng
- Sulfur có nhiều ứng dụng như: điều chế H2SO4, lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,…
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 35 Hóa học 11: Sulfur (lưu huỳnh) còn được gọi là lưu hoàng, sinh diêm vàng, diêm sinh, đã được biết đến từ thời cổ đại. Nguyên tố sulfur có những tính chất gì và được ứng dụng vào sản xuất, đời sống của con người như thế nào?...
Câu hỏi thảo luận 1 trang 35 Hóa học 11: Quan sát Hình 6.1 và 6.2, hãy cho biết trong tự nhiên, sulfur tồn tại ở những dạng chất nào?...
Câu hỏi thảo luận 2 trang 36 Hóa học 11: Quan sát Hình 6.3, hãy nêu một số tính chất vật lí của sulfur....
Câu hỏi thảo luận 3 trang 36 Hóa học 11: Quan sát Hình 6.4, mô tả cấu tạo phân tử sulfur....
Câu hỏi thảo luận 4 trang 36 Hóa học 11: Nêu hiện tượng xảy ra ở Thí nghiệm 1. Xác định vai trò của các chất trong phản ứng của Fe và S ở thí nghiệm này....
Câu hỏi thảo luận 5 trang 37 Hóa học 11: Nêu hiện tượng xảy ra và xác định vai trò của S, O2 trong phương trình hoá học của phản ứng ở Thí nghiệm 2....
Luyện tập trang 37 Hóa học 11: Viết phương trình hoá học của phản ứng xảy ra khi cho nhôm (aluminium) và kẽm (zinc) tác dụng với sulfur....
Vận dụng trang 37 Hóa học 11: Thuỷ ngân rất độc. Hít phải hơi thuỷ ngân có thể gây hại cho hệ thần kinh, hệ tiêu hoá và hệ miễn dịch, gây nhiễm độc phổi và thận, nguy cơ dẫn đến tử vong. Hãy nêu cách xử lí thuỷ ngân khi nhiệt kế thuỷ ngân không may bị vỡ....
Câu hỏi thảo luận 6 trang 37 Hóa học 11: Hãy nêu một số ứng dụng của sulfur đơn chất trong đời sống và sản xuất....
Câu hỏi thảo luận 7 trang 38 Hóa học 11: Xác định tính oxi hoá, tính khử của mỗi chất trong các phản ứng hoá học (1) và (2)....
Câu hỏi thảo luận 8 trang 38 Hóa học 11: Nêu một số nguồn phát thải sulfur dioxide và tác hại của loại khí này....
Câu hỏi thảo luận 9 trang 38 Hóa học 11: Giải thích sự hình thành mưa acid từ sulfur dioxide....
Vận dụng trang 39 Hóa học 11: Em hãy tìm hiểu và đề xuất một số giải pháp phù hợp với lứa tuổi học sinh giúp giảm thiểu lượng sulfur dioxide thải vào không khí....
Bài 1 trang 39 Hóa học 11: Tính chất nào sau đây không phải là tính chất vật lí của sulfur?...
Bài 2 trang 39 Hóa học 11: Số oxi hoá của sulfur trong phân tử SO2 là...
Bài 3 trang 39 Hóa học 11: Cho các phản ứng sau:...
Bài 4 trang 39 Hóa học 11: Khí SO2 do các nhà máy thải ra là nguyên nhân chính trong việc gây ô nhiễm môi trường. Theo quy chuẩn kĩ thuật quốc gia về chất lượng không khí xung quanh (QCVN 05:2013/BTNMT) thì nếu lượng SO2 vượt quá 350 μg/m3 không khí đo trong 1 giờ ở một thành phố thì coi như không khí bị ô nhiễm. Nếu người ta lấy 50 lít không khí trong 1 giờ ở một thành phố và phân tích thấy có 0,012 mg SO2 thì không khí ở đó có bị ô nhiễm không?...
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: