Với giải sách bài tập Hóa học 11 Bài 6: Sulfur và sulfur dioxide sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 6: Sulfur và sulfur dioxide
Bài 6.1 trang 25 SBT Hóa học 11: Phát biểu nào sau đây không đúng?
A. Lưu huỳnh là một nguyên tố phi kim, chỉ có tính oxi hoá.
B. Khi tham gia phản ứng, lưu huỳnh thể hiện tính oxi hoá hoặc tính khử.
C. Ở điều kiện thường, lưu huỳnh là chất rắn, màu vàng, không tan trong nước.
D. Ở điều kiện thường, lưu huỳnh tồn tại dạng phân tử tám nguyên tử (S8).
Lời giải:
Lưu huỳnh là một nguyên tố phi kim, vừa có tính oxi hóa, vừa có tính khử.
→ Chọn A.
Bài 6.2 trang 25 SBT Hóa học 11: Cho các phản ứng hoá học sau:
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3.
B. 2.
C. 4.
D. 1.
Lời giải:
Trong các phản ứng trên, các phản ứng trong đó S thể hiện tính khử (số oxi hóa tăng): (1), (2), (4).
→ Chọn A.
A. mưa acid.
B. hiện tượng khí nhà kính.
C. suy giảm tầng ozone.
D. nước thải gây ung thư.
Lời giải:
Khí SO2 sinh ra từ việc đốt các nhiên liệu hoá thạch, các quặng sulfide là một trong các chất gây ô nhiễm môi trường, do SO2 góp phần gây ra mưa acid.
→ Chọn A.
A. NH3.
B. CO2.
C. SO2.
D. O3.
Lời giải:
Khí SO2 tan trong nước tạo ra dung dịch làm quỳ tím hóa đỏ và SO2 có thể được dùng làm chất tẩy màu.
→ Chọn C.
Bài 6.5 trang 25 SBT Hóa học 11: Cho các phương trình hoá học sau:
(1) SO2 + 2H2S → 3S + 2H2O
(2) SO2 + Br2+ 2H2O → 2HBr + H2SO4
Phát biểu nào sau đây đúng?
A. SO2 chỉ thể hiện tính oxi hoá.
B. SO2 chỉ thể hiện tính khử.
C. SO2 vừa thể hiện tính oxi hoá, vừa thể hiện tính khử.
D. SO2 không thể hiện tính khử và không thể hiện tính oxi hoá.
Lời giải:
Trong phương trình (1), SO2 thể hiện tính oxi hoá.
Trong phương trình (2), SO2 thể hiện tính khử.
→ Chọn C.
Lời giải:
Dùng nam châm hút sắt ra khỏi hỗn hợp.
Lời giải:
Giả sử Sx là công thức phân tử của hơi lưu huỳnh ở 900 °C.
Mặt khác:
=> Công thức phân tử của hơi lưu huỳnh ở 900 °C là S2
Lời giải:
Đốt cháy lưu huỳnh sinh ra khí SO2 độc. Tuy nhiên ở nồng độ thấp, khí này có tác dụng diệt khuẩn. Việc xông khí lưu huỳnh giúp việc bảo quản thuốc không bị mối mọt hay nấm mốc tấn công hoặc hoa quả tươi lâu hơn. Tuy nhiên, trong quá trình xông, lưu huỳnh sẽ lưu lại trên thuốc làm thuốc bị cứng, thay đổi màu sắc, mùi vị. SO2gặp hơi ẩm trong phổi tạo thành H2SO3 ảnh hưởng đến phổi và hệ thần kinh,...
Lời giải:
Nguồn cung cấp lưu huỳnh tự do chủ yếu là do khai thác từ lòng đất theo phương pháp Frasch. Ngoài ra lưu huỳnh còn được tái chế từ các khí thải độc hại như SO2 (sản phẩm phụ trong công nghiệp luyện kim màu), H2S (được tách từ khí tự nhiên) theo các phản ứng:
2H2S + O2→ 2S↓ + 2H2O
2H2S + SO2 → 3S↓ + 2H2O
Lời giải:
Khi thu hồi thuỷ ngân rơi vãi người ta thường sử dụng bột lưu huỳnh rắc lên những chỗ có thuỷ ngân, vì lưu huỳnh có thể tác dụng với thuỷ ngân tạo thành HgS dạng rắn và không bay hơi:
Khi vô tình làm vỡ nhiệt kế thuỷ ngân trong phòng thí nghiệm, cần rắc ngay bột lưu huỳnh bao phủ tất cả các mảnh vỡ. Sau đó dùng chổi quét sạch, gói vào giấy và cho vào thùng rác.
Lời giải:
Với xúc tác là các ion kim loại trong khói bụi, SO2 bị oxi hóa và hòa tan trong nước mưa tạo thành sulfuric acid (H2SO4) gây ra mưa acid.
Mưa acid, gây tổn hại cho nhiều công trình làm bằng sắt, đá:
Lời giải:
Lưu huỳnh cháy sinh ra khí SO2 gây độc cho hệ hô hấp của con người và có thể dẫn đến tử vong. Người dân có thể đối mặt với nguy cơ mưa acid trong khu vực.
Lời giải:
- Phương trình hóa học:
+ Sản xuất SO2 từ S:
+ Sản xuất SO2 từ quặng pyrit sắt (FeS2):
- Ưu điểm:
+ Là những nguyên liệu có sẵn trong tự nhiên, dễ khai thác.
+ Không tạo ra sản phẩm phụ tác động đến môi trường.
+ Phản ứng xảy ra đơn giản, hiệu suất cao.
- Nhược điểm:
+ Tài nguyên thiên nhiên cạn kiệt.
+ Quá trình khai thác có thể ảnh hưởng đến hệ sinh thái, môi trường đất xung quanh.
|
Sản phẩm |
%O2 (về thể tích) |
%CO2 (về thể tích) |
|
Táo |
4 |
2 |
|
Dâu tây |
2,5 |
16 |
|
Đậu Hà Lan |
9 |
7 |
|
Cần tây |
11 |
9 |
Bảng tổng hợp ở trên cho biết thành phần của hỗn hợp khí sử dụng đối với mỗi loại rau quả giúp chúng có thời hạn sử dụng lâu nhất. Khí còn lại là nitrogen.
a) Dựa vào bảng số liệu trên, hãy cho biết loại rau quả tươi nào ở trong bảng được đóng gói với hỗn hợp khí có thành phần N2 giống với không khí nhất?
A. Táo.
B. Dâu tây.
C. Đậu Hà Lan.
D. Cần tây.
b) Thực tế, do lợi ích kinh tế trước mắt mà nhiều tổ chức, cá nhân đã sử dụng hoá chất độc hại để bảo quản trái cây. Việc dùng hoá chất làm cho trái cây giữ được rất lâu. Những giải pháp bảo quản trái cây nào được cho là an toàn và không an toàn với người dùng? Đánh dấu ✔ vào bảng sau ở ô thích hợp.
|
Giải pháp |
An toàn |
Không an toàn |
|
(1) Dùng hóa chất SO2 để bảo quản trái cây. |
|
|
|
(2) Bảo quản trái cây trong tủ lạnh. |
|
|
|
(3) Kĩ thuật đóng gói bổ sung khí MAP. |
|
|
Lời giải:
a)
|
Sản phẩm |
%O2 (về thể tích) |
%CO2 (về thể tích) |
%N2 (về thể tích) |
|
Táo |
4 |
2 |
94 |
|
Dâu tây |
2,5 |
16 |
81,5 |
|
Đậu Hà Lan |
9 |
7 |
84 |
|
Cần tây |
11 |
9 |
80 |
Cần tây được đóng gói với hỗn hợp khí có thành phần N2 giống với không khí nhất.
→ Chọn D.
b)
|
Giải pháp |
An toàn |
Không an toàn |
|
(1) Dùng hóa chất SO2 để bảo quản trái cây. |
|
✔ |
|
(2) Bảo quản trái cây trong tủ lạnh. |
✔ |
|
|
(3) Kĩ thuật đóng gói bổ sung khí MAP. |
✔ |
|
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
Bài 8: Hợp chất hữu cơ và hóa học hữu cơ
Lý thuyết Sulfur và sulfur dioxide
1. Đơn chất Sulfur
a) Trạng thái tự nhiên:
- Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét.
- Khoáng vật trong tự nhiên chứa sulfur ở dạng hợp chất: quặng pyrite (FeS2), quặng gypsum (CaSO4.2H2O), quặng galena (PbS), quặng barite (BaSO4).
b) Cấu tạo, tính chất vật lý cơ bản của sulfur đơn chất
- Ở dạng phân tử, 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng. Kí hiệu là S.
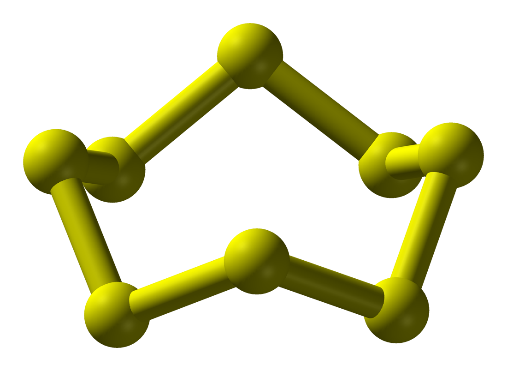
Hình 1: Phân tử sulfur ở điều kiện thường
-Ở điều kiện thường sulfur là: chất rắn, màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ (benzine, carbon disulfide,…)
c) Tính chất hóa học
- Tính oxi hóa: sulfur oxi hóa được nhiều kim loại (trừ Au, Pt, Ag) ở nhiệt độ cao -> Muối sulfide
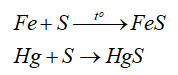
-Tính khử:
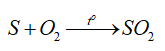
d) Ứng dụng
- Sulfur có nhiều ứng dụng như: điều chế H2SO4, lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,…
2. Sulfur dioxide
a) Tính chất hóa học và ứng dụng
- SO2 là chất khí không màu, mùi xốc, độc, nặng hơn không khí 2 lần, hóa lỏng ở -10℃ , tan nhiều trong nước.
- Tính khử: SO2 là chất khử khi tác dụng với chất oxi hóa mạnh (halogen, potassium permanganate, nitrogen dioxide,…)
-Tính oxi hóa: SO2 là chất oxi hóa khi tác dụng với chất khử mạnh (H2S, Mg, …)
-Sulfur dioxide được dùng để sản xuất sulfuric acid; tẩy trắng giấy; chống nấm mốc cho lương thực, thực phẩm,…
b) Sự hình thành sulfur dioxide, tác hại của sulfur dioxide và một số biện pháp giảm thiểu lượng sulfur dioxide thải vào không khí
- Sulfur dioxide được sinh ra trong tự nhiên và do tác động của con người

-Sulfur dioxide là một trong các chất chủ yếu gây ô nhiễm môi trường không khí và có hại cho sức khỏe của con người; sự phát thải SO2 vào bầu khí quyển cũng là một trong những nguyên nhân gây mưa acid.
-Một số biện pháp giảm lượng khí thải này:
+ Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường thay cho nguồn năng lượng hóa thạch.
+ Khai thác các nguồn năng lượng tái tạo như: năng lượng mặt trời, năng lượng gió, mưa, sóng biển,…
+ Xử lí khí thải công nghiệp trước khi thải ra môi trường.