Với giải Em có thể trang 37 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 5: Ammonia. Muối ammonium giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 5: Ammonia. Muối ammonium
Em có thể trang 37 Hóa học 11: - Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia trong quá trình Haber – Bosch.
- Nhận biết được ion ammonium trong phân đạm.
Lời giải:
- Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC, áp suất 150 – 200 bar, xúc tác Fe.
+ Về áp suất: người ta đã tăng áp suất của hệ phản ứng trong buồng tổng hợp lên đến gần 200 bar. Đó là do khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ - tức chiều giảm số mol khí, hay chiều tạo ammonia (chiều thuận).
+ Về nhiệt độ: Vì phản ứng thuận toả nhiệt (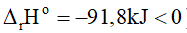
+ Việc sử dụng xúc tác là bột sắt trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
- Nhận biết ion ammonium trong phân đạm: Khi đun nóng hỗn hợp phân đạm chứa muối ammonium với dung dịch kiềm sinh ra khí ammonia có mùi khai.
Phương trình hoá học minh hoạ:
NH4NO3 + NaOH 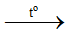
NH4Cl + NaOH 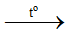
Lý thuyết Muối Ammonium
a. Tính tan, sự điện li
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
Ví dụ: NH4Cl → NH4+ + Cl-
b. Tác dụng với kiềm
Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammunia với mùi khai.
Ví dụ: (NH4)2SO4 +2NaOH → Na2SO4 +2NH3 + 2H2O
c. Tinh chất kém bền nhiệt
Các muối ammonium đều kém bền nhiệt và dễ bị phân huỷ khi nung nóng.
d. Ứng dụng
- Thuốc long đờm
- Phân bón hóa học
- Chất phụ gia thực phẩm
- Chất đánh sạch bề mặt kim loại
- Thuốc bổ sung chất điện giải
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Hoạt động 2 trang 33 Hóa học 11: Trình bày các bước lập công thức Lewis của phân tử ammonia....
Câu hỏi 2 trang 34 Hóa học 11: Hãy giải thích tại sao ammonia tan tốt trong .......
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm.....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate