Với giải Thí nghiệm trang 36 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 5: Ammonia. Muối ammonium giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 5: Ammonia. Muối ammonium
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm
Chuẩn bị: phân bón potassium nitrate và phân bón ammonium chloride dạng rắn, dung dịch NaOH 20%, giấy pH; bình xịt tia nước cất, 2 ống nghiệm, kẹp gỗ, đèn cồn.
Tiến hành:
– Cho khoảng 1 g phân bón potassium nitrate vào ống nghiệm (1) và khoảng 1 g phân bón ammonium chloride vào ống nghiệm (2).
– Thêm vào mỗi ống nghiệm khoảng 3 mL nước cất, lắc đều cho tan hết.
– Nhỏ 1 mL dung dịch NaOH 20% vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
– Đưa hai mẩu giấy pH đã tẩm ướt vào miệng mỗi ống nghiệm.
Quan sát hiện tượng và trả lời câu hỏi:
Dựa vào dấu hiệu nào để nhận biết ion ammonium? Giải thích bằng phương trình hoá học.
Lời giải:
- Hiện tượng:
+ Hai mẫu phân bón đều dễ tan trong nước.
+ Đun nhẹ hai ống nghiệm đều thấy thoát ra khí không màu, có mùi khai và xốc.
+ So sánh màu ở mẩu giấy pH với thang pH thấy tạo thành môi trường base.
- Dấu hiệu để nhận biết ion ammonium: Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm sinh ra khí ammonia có mùi khai.
Phương trình hoá học:
NH4NO3 + NaOH 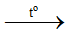
NH4Cl + NaOH 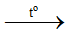
Lý thuyết Muối Ammonium
a. Tính tan, sự điện li
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
Ví dụ: NH4Cl → NH4+ + Cl-
b. Tác dụng với kiềm
Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammunia với mùi khai.
Ví dụ: (NH4)2SO4 +2NaOH → Na2SO4 +2NH3 + 2H2O
c. Tinh chất kém bền nhiệt
Các muối ammonium đều kém bền nhiệt và dễ bị phân huỷ khi nung nóng.
d. Ứng dụng
- Thuốc long đờm
- Phân bón hóa học
- Chất phụ gia thực phẩm
- Chất đánh sạch bề mặt kim loại
- Thuốc bổ sung chất điện giải
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Hoạt động 2 trang 33 Hóa học 11: Trình bày các bước lập công thức Lewis của phân tử ammonia....
Câu hỏi 2 trang 34 Hóa học 11: Hãy giải thích tại sao ammonia tan tốt trong .......
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm.....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate