Với giải Hoạt động trang 34 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 5: Ammonia. Muối ammonium giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 5: Ammonia. Muối ammonium
Hoạt động trang 34 Hóa học 11: Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
NH3 + HCl → NH4Cl
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
Lời giải:
Xét phản ứng: NH3 + HCl → NH4Cl
Chất cho proton là HCl, chất nhận proton là NH3:
Xét phản ứng: NH3 + HNO3 → NH4NO3
Chất cho proton là HNO3, chất nhận proton là NH3:
Xét phản ứng: 2NH3 + H2SO4 → (NH4)2SO4
Chất cho proton là H2SO4, chất nhận proton là NH3:
Lý thuyết Ammonia
a. Cấu tạo phân tử
Phân tử ammonia được tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác:
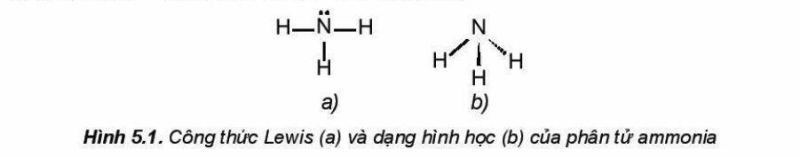
Đặc điểm cấu tạo của phân tử ammonia:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen
- Liên kết N-H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần đến Tịch Dương.
- Liên kết N-H tương đối bền với năng lượng liên kết là386 kJ/mol.
b. Tính chất vật lí
Ammonia tồn tại ở cả trong môi trường đất, nước, không khi. Trong cơ thể người. ammonia được tạo ra trong quá trình chuyển hoá thức ăn chứa protein.
Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc. Ammonia tan nhiều trong nước. Ở điều kiện thường, 1 lít nước hoà tan được khoảng 700 lit khi ammonia. Ammonia dễ hoá lỏng (hoá lỏng ở -33,3 °C) và dễ hoá rắn (hóa rắn ở –77,7 °C).
c. Tính chất hoá học
* Tính base:
Dung dịch ammonia có môi trường base yếu, làm quỳ tím chuyển màu xanh, phenolphthalein chuyển màu hồng.
Ở thể khí, ammonia cũng có khả năng nhận proton, thể hiện tính chất của một base Bronsted-Lowry.
Ví dụ: NH3(g) + HCl(g) → NH4Cl(s)
* Tính khử
Trong phân tử ammonia, nguyên tử nitrogen có số oxi hoá −3 (số oxi hóa thấp nhất của nitrogen) nên ammonia thể hiện tính khử.
d. Ứng dụng
- Tác nhân làm lạnh.
- Sản xuất nitric acid.
- Dung môi.
- Sản xuất phân đạm.
e. Sản xuất
Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 °C – 450 °C, áp suất 150 – 200 bar, xúc tác Fe.
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Hoạt động 2 trang 33 Hóa học 11: Trình bày các bước lập công thức Lewis của phân tử ammonia....
Câu hỏi 2 trang 34 Hóa học 11: Hãy giải thích tại sao ammonia tan tốt trong .......
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm.....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate