Với giải Câu hỏi 4 trang 37 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 5: Ammonia. Muối ammonium giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 5: Ammonia. Muối ammonium
Câu hỏi 4 trang 37 Hóa học 11: a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hoá trị, số oxi hoá của nguyên tử nitrogen.
b) Viết phương trình hoá học minh hoạ tính acid/base của ammonia và ammonium.
Lời giải:
a)
|
Phân tử/ Ion |
Dạng hình học |
Số liên kết cộng hoá trị của nitrogen |
Số oxi hoá của nitrogen |
|
Ammonia (NH3) |
Chóp tam giác |
3 |
-3 |
|
Ammonium (NH4+) |
Tứ diện |
4 |
-3 |
b)
- NH3 có tính base. Một số phương trình hoá học minh hoạ:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4.
- NH4+ có tính acid. Một số phương trình hoá học minh hoạ:
NH4NO3 + NaOH 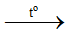
NH4Cl + NaOH 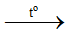
Phương trình ion rút gọn:
NH4+ + OH− → NH3 + H2O.
Lý thuyết Muối Ammonium
a. Tính tan, sự điện li
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
Ví dụ: NH4Cl → NH4+ + Cl-
b. Tác dụng với kiềm
Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammunia với mùi khai.
Ví dụ: (NH4)2SO4 +2NaOH → Na2SO4 +2NH3 + 2H2O
c. Tinh chất kém bền nhiệt
Các muối ammonium đều kém bền nhiệt và dễ bị phân huỷ khi nung nóng.
d. Ứng dụng
- Thuốc long đờm
- Phân bón hóa học
- Chất phụ gia thực phẩm
- Chất đánh sạch bề mặt kim loại
- Thuốc bổ sung chất điện giải
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Hoạt động 2 trang 33 Hóa học 11: Trình bày các bước lập công thức Lewis của phân tử ammonia....
Câu hỏi 2 trang 34 Hóa học 11: Hãy giải thích tại sao ammonia tan tốt trong .......
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm.....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 6: Một số hợp chất của nitrogen với oxygen
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate