Lời giải bài tập Hóa học lớp 10 Bài 15: Phản ứng oxi hóa - khử sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 15 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 15: Phản ứng oxi hóa - khử
Video giải Hóa học 10 Bài 15: Phản ứng oxi hóa - khử - Kết nối tri thức
Giải hóa học 10 trang 71 Kết nối tri thức
Mở đầu trang 71 Hóa học 10: Trong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ sau:
Fe2O3+ CO Fe + CO2
Về bản chất, phản ứng oxi hóa - khử là gì, dựa vào dấu hiệu nào để nhận ra loại phản ứng đó?
Làm thế nào để lập phương trình hóa học của phản ứng trên.
Phương pháp giải:
- Phản ứng oxi hóa – khử xảy ra đồng thời quá trình nhường và nhận.
- Trong phản ứng oxi hóa khử, có sự thay đổi số oxi hóa.
- Nguyên tắc lập phương trình hóa học của phản ứng oxi hóa – khử là tổng số electron nhường bằng tổng số electron nhận.
Lời giải:
- Về bản chất, phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình nhường và quá trình nhận electron.
- Dấu hiệu để nhận ra loại phản ứng oxi hóa – khử là có sự thay đổi số oxi của các nguyên tử.
- Các bước lập phương trình hóa học của phản ứng oxi hóa – khử:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
Nguyên tử Fe và C có sự thay đổi số oxi hóa, Fe là chất oxi hóa, C là chất khử
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
Fe+3 + 3e → Fe0
C+2 → C+4 + 2e
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc tổng electron nhường bằng tổng electron nhận.
2x /Fe+3 + 3e → Fe0
3x /C+2 → C+4 + 2e
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng.
Fe2O3+ 3CO 2Fe + 3CO2
Giải hóa học 10 trang 73 Kết nối tri thức
I. Số oxi hóa
Câu 1 trang 73 Hóa học 10: Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau:
a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4.
b) S, H2S, SO2, SO3, H2SO4, Na2SO3.
Phương pháp giải:
Quy tắc xác định số oxi hóa:
- Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
- Trong hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương bằng số electron hóa trị.
- Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
- Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Lời giải:


Giải hóa học 10 trang 74 Kết nối tri thức
II. Chất oxi hóa, chất khử, phản ứng oxi hóa - khử
Fe(OH)2 + O2 + H2O → Fe(OH)3
a) Hãy xác định các nguyên tử có sự thay đổi số oxi hóa.
b) Viết quá trình oxi hóa, quá trình khử.
c) Dùng mũi tên biểu diễn sự chuyển electron từ chất khử sang chất oxi hóa
Phương pháp giải:
- Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
- Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
a)
- Trong Fe(OH)2, iron có số oxi hóa +2
- Trong Fe(OH)3, iron có số oxi hóa +3
=> Nguyên tử iron có sự thay đổi số oxi hóa từ +2 lên +3.
- Trong O2, oxygen có số oxi hóa 0
- Trong Fe(OH)3, oxygen có số oxi hóa -2
=> Nguyên tử oxygen có sự thay đổi số oxi hóa từ 0 xuống -2.
b)
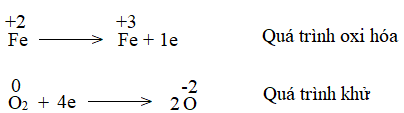
c)
1 phân tử Fe(OH)2 nhường 1 electron => 4 phân tử Fe(OH)2 nhường 4 electron
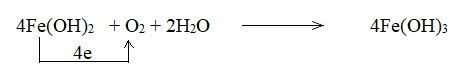
Giải hóa học 10 trang 75 Kết nối tri thức
III. lập phương trình hóa học của phản ứng oxi hóa - khử
Câu 3 trang 75 Hóa học 10: Xét các phản ứng hóa học xảy ra trong công nghiệp:
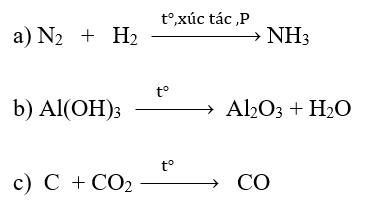
Phản ứng nào là phản ứng oxi hóa – khử? Lập phương trình hóa học của phản ứng oxi hóa khử theo phương pháp thăng bằng electron.
Phương pháp giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:
a)
Nguyên tử N trong phản ứng có sự thay đổi số oxi hóa từ 0 xuống -3
=> Phản ứng oxi hóa – khử.
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
![]()
Bước 2: Biểu diễn quá trình oxi hóa – khử:
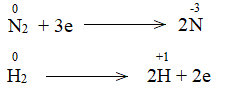
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
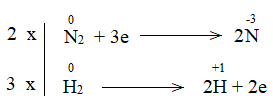
Bước 4: Đặt hệ số
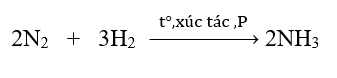
b)
Trước phản ứng, các nguyên tử Al, O và H có số oxi hóa lần lượt là +3, -2, +1
Sau phản ứng, các nguyên tử Al, O và H có số oxi hóa lần lượt là +3, -2, +1.
=> Trong phản ứng, các nguyên tử không có sự thay đổi số oxi hóa => Không là phản ứng oxi hóa – khử.
c)
Trong phản ứng, C trước phản ứng có số oxi hóa 0. Kết thúc phản ứng, C có số oxi hóa +2
=> Phản ứng oxi hóa khử
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
![]()
Bước 2: Biểu diễn quá trình oxi hóa – khử:
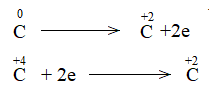
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
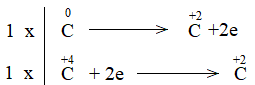
Bước 4: Đặt hệ số
C + CO2 2CO
Giải hóa học 10 trang 76 Kết nối tri thức
IV. Phản ứng oxi hóa - khử trong thực tiễn
Câu 4 trang 76 Hóa học 10: Nêu một số phản ứng oxi hóa – khử có lợi và có hại trong thực tế.
Phương pháp giải:
- Sự cháy là phản ứng oxi hóa - khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa.
- Phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử.
- Sự han gỉ các đồ vật, thiết bị làm bằng kim loại do sự oxi hóa của oxygen.
Lời giải:
Phản ứng oxi hóa – khử có lợi: sự cháy,…
Phản ứng oxi hóa – khử có hại: sự han gỉ các thiết bị, đồ dùng được làm bằng sắt,…
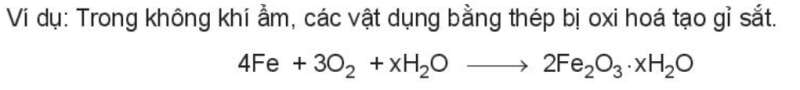
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:

C2H2 + O2 CO2 + H2O
Phản ứng tỏa nhiệt lớn, tạo ra ngọn lửa có nhiệt độ đạt đến 30000C nên được dùng để hàn cắt kim loại.
Hãy xác định chất oxi hóa, chất khử và lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron.
Phương pháp giải:Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
Bước 1:
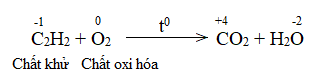
Bước 2:
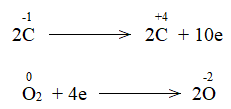
Bước 3:
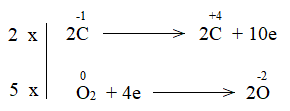
Bước 4:
2C2H2 + 5O2 4CO2 + 2H2O
Giải hóa học 10 trang 77 Kết nối tri thức
C + O2 CO2
Khí CO2 đi lên phía trên, gặp các lớp than cốc và bị khử thành CO:
CO2 + C CO
Tiếp đó, khí CO khử Fe2O3 theo phản ứng tổng quát:
Fe2O3 + CO Fe + CO2
Lập các phương trình hóa học ở trên, chỉ rõ chất oxi hóa, chất khử
Phương pháp giải:
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
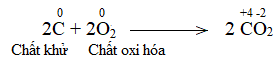
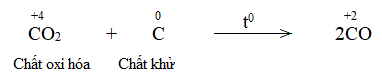
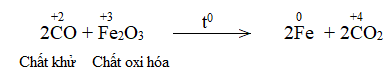
Lý thuyết Phản ứng oxi hóa - khử
I. Số oxi hóa
1. Khái niệm
Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Số oxi hóa được viết ở dạng số đại số, dấu viết trước, số viết sau.
Ví dụ 1: Xét phân tử NaCl.
Nguyên tử Na nhường 1 electron cho nguyên tử Cl, khi đó nguyên tử Na trở thành ion dương mang điện tích 1+ (số oxi hóa của Na là +1) và nguyên tử Cl nhận 1 electron của nguyên tử Na trở thành ion âm mang điện tích 1– (số oxi hóa của Cl là –1): .
Ví dụ 2: Xét phân tử H2O.

Độ âm điện của nguyên tử O lớn hơn độ âm điện của nguyên tử H, nếu các cặp electron liên kết chuyển hoàn toàn về nguyên tử O thì nguyên tử O có thêm 2 electron và trở thành ion âm có điện tích 2– (số oxi hóa của O là –2); mỗi nguyên tử H mất đi 1 electron và trở thành ion dương có điện tích 1+ (số oxi hóa của H là +1): .
Ví dụ 3: Xét phân tử H2.
H : H
Do hai nguyên tử H giống nhau nên cặp electron liên kết không lệch về nguyên tử nào. Do vậy, mỗi nguyên tử H đều trung hòa điện, có điện tích bằng 0 và số oxi hóa là 0: .
2. Quy tắc xác định số oxi hóa
Thông thường, số oxi hóa của nguyên tử được xác định trực tiếp từ công thức phân tử theo các quy tắc sau:
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ: .
Quy tắc 2: Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là – 2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.

Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ 1: Xác định số oxi hóa của S trong phân tử Na2SO4.
Hướng dẫn:
Trong hợp chất, số oxi hóa của Na là +1, số oxi hóa của O là –2.
Số oxi hóa của từng nguyên tử: .
Áp dụng quy tắc 3, ta có: (+1)×2 + x + (–2)×4 = 0 ® x = +6.
Ví dụ 2: Xác định số oxi hóa của C trong ion .
Hướng dẫn:
Số oxi hóa của O là – 2.
Gọi số oxi hóa của C trong ion đa nguyên tử là x.
Áp dụng quy tắc 4, ta có: x + (–2)×3 = –2 x = +4.
II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử
1. Chất oxi hóa, chất khử
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
Ví dụ: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí O2, mẩu than cháy sáng.
Trong phản ứng trên, nguyên tử C nhường 4 electron, là chất khử; phân tử O2 nhận 4 electron, là chất oxi hóa.
(quá trình oxi hóa)
(quá trình khử)
2. Phản ứng oxi hóa – khử
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Ví dụ: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
(a) CaCO3 CaO + CO2.
(b) BaCl2 + Na2SO4 BaSO4¯ + 2NaCl.
(c) 4Al + 3O2 2Al2O3.
Hướng dẫn giải:
(a) Không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
(b) Không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
(c) : có sự thay đổi số oxi hóa của nguyên tố Al, O Đây là phản ứng oxi hóa – khử.
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
Phương pháp thăng bằng electron đường dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc: “Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”.
Ví dụ: Cân bằng phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron: NH3 + O2NO + H2O.
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử:
NH3: chất khử; O2: chất oxi hóa.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
4NH3 + 5O2 4NO + 6H2O
IV. Phản ứng oxi hóa – khử trong thực tiễn
1. Sự cháy
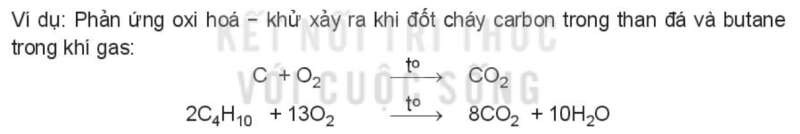
Phản ứng cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa. Chất cháy thường là nhiên liệu (than đá, khí thiên nhiên, xăng dầu, …), còn chất oxi hóa thường là oxygen.
Ví dụ: Phản ứng oxi hóa – khử xảy ra khi đốt cháy carbon trong than đá và butane trong khí gas:
C + O2 CO2
2C4H10 + 13O2 8CO2 + 10H2O
2. Sự han gỉ kim loại
Sau một thời gian sử dụng, nhiều thiết bị, máy móc, vật dụng bằng kim loại thường bị han gỉ, do sự oxi hóa bởi oxygen trong không khí.
Ví dụ: Trong không khí ẩm, các vật dụng bằng thép bị oxi hóa tạo gỉ sắt.
4Fe + 3O2 + xH2O 2Fe2O3.xH2O
3. Sản xuất hóa chất
Trong công nghiệp, phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử.
Ví dụ: Sulfuric acid là hóa chất quan trọng trong công nghiệp, được sản xuất chủ yếu từ sulfur hoặc quặng pyrite.
Sơ đồ phản ứng;
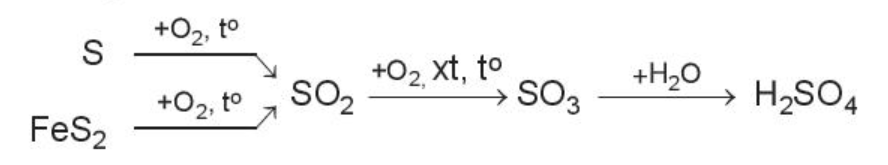
4. Chuyển hóa các chất trong tự nhiên
Trong tự nhiên cũng xảy ra rất nhiều quá trình kèm theo phản ứng oxi hóa – khử.
Ví dụ: Tia sét tạo tia lửa điện, là điều kiện cho nitrogen phản ứng với oxygen:
N2 + O2 2NO
Khí NO sinh ra nhanh chóng chuyển hóa thành NO2, sau đó tiếp tục bị oxi hóa thành HNO3:
2NO + O2 2NO2
4NO2 + O2 + 2H2O 4HNO3
Nitric acid tan vào nước mưa và chuyển hóa thành gốc nitrate () , cung cấp chất đạm cho cấy lúa. Nhờ quá trình trên, hàng năm một lượng lớn phân đạm tự nhiên được bổ sung cho đất.
5. Xác định nồng độ của một chất dựa vào phản ứng oxi hóa – khử
- Trong thực tế, dung dịch thuốc tím (KMnO4) được sử dụng phổ biến như một tác nhân oxi hóa mạnh để xác định hàm lượng các chất khử như iron(II); hydrogen peroxide, oxalic acid, …
Ví dụ: Trong quá trình bảo quản, một mẫu iron (II) sulfate bị oxi hóa một phần thành hợp chất iron (III). Hàm lượng iron (II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với dung dịch thuốc tím có nồng độ đã biết:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Bài giảng Hóa học 10 Bài 15: Phản ứng oxi hóa - khử - Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa - khử