Với Giải hóa học lớp 10 trang 76 Kết nối tri thức chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 76 Kết nối tri thức
Câu 4 trang 76 Hóa học 10: Nêu một số phản ứng oxi hóa – khử có lợi và có hại trong thực tế.
Phương pháp giải:
- Sự cháy là phản ứng oxi hóa - khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa.
- Phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử.
- Sự han gỉ các đồ vật, thiết bị làm bằng kim loại do sự oxi hóa của oxygen.
Lời giải:
Phản ứng oxi hóa – khử có lợi: sự cháy,…
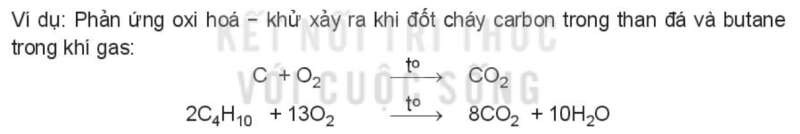
Phản ứng oxi hóa – khử có hại: sự han gỉ các thiết bị, đồ dùng được làm bằng sắt,…
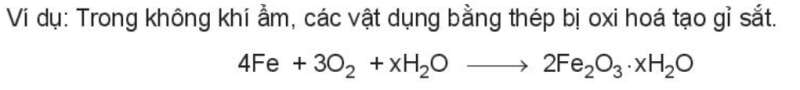
Câu 5 trang 76 Hóa học 10: Lập phương trình hóa học của các phản ứng trong quá trình sản xuất sulfuric acid theo sơ đồ mục IV.3. Trong các phản ứng đó, phản ứng nào là phản ứng oxi hóa – khử?
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:

Câu 6 trang 76 Hóa học 10: Đèn xì ogygen – acetylene có cấu tạo gồm hai ống dẫn khí: một ống dẫn khí oxygen, một ống dẫn khí acetylene (Hình 15.1). Khi đèn hoạt động, hai khí này được trộn vào nhau để thực hiện phản ứng đốt cháy theo sơ đồ:
C2H2 + O2 CO2 + H2O
Phản ứng tỏa nhiệt lớn, tạo ra ngọn lửa có nhiệt độ đạt đến 30000C nên được dùng để hàn cắt kim loại.
Hãy xác định chất oxi hóa, chất khử và lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron.
Phương pháp giải:Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
Bước 1:
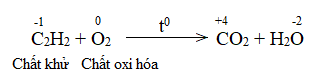
Bước 2:
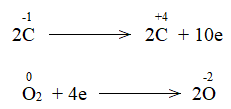
Bước 3:
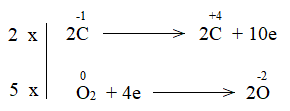
Bước 4:
2C2H2 + 5O2 4CO2 + 2H2O
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: