Lời giải bài tập Hóa học lớp 10 Bài 16: Ôn tập chương 4 sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 16 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 16: Ôn tập chương 4
I. Hệ thống hóa kiến thức
Giải hóa học 10 trang 78 Kết nối tri thức
II. Luyện tập
Câu 1 trang 78 Hóa học 10: Trong phản ứng oxi hóa – khử, chất oxi hóa là chất:
A. nhận electron
B. nhường proton
C. nhường electron
D. nhận proton
Phương pháp giải:
Chất oxi hóa là chất nhận electron
Lời giải:
Đáp án A
Câu 2 trang 78 Hóa học 10: Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã
A. nhường 2 electron
B. nhận 2 electron
C. nhường 1 electron
D. nhận 1 electron
Phương pháp giải:
![]()
Lời giải:
Trong phản ứng, Fe từ số oxi hóa 0 lên số oxi hóa +2
=> Mỗi nguyên tử Fe đã nhường 2 electron
=> Đáp án A
Câu 3 trang 78 Hóa học 10: Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là
A. H2O
B. NaOH
C. Na
D. H2
Phương pháp giải:
Chất oxi hóa là chất nhận electron
Lời giải:
![]()
Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là H2O
=> Đáp án A
Câu 4 trang 78 Hóa học 10: Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hóa học:
Cl2 + 2NaBr → 2NaCl + Br2
Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào?
A. NaCl.
B. Br2.
C. Cl2.
D. NaBr.
Phương pháp giải:
Quá trình oxi hóa là quá trình chất khử nhường electron.
Lời giải:
![]()
Trong phản ứng hóa học Cl2 + 2NaBr 2NaCl + Br2, xảy ra quá trình oxi hóa chất NaBr
=> Đáp án D
Giải hóa học 10 trang 79 Kết nối tri thức
Câu 5 trang 79 Hóa học 10: Xét các phản ứng hóa học xảy ra trong các quá trình sau:
a) Luyện gang từ quặng hematit đó:
Fe2O3 + CO FeO + CO2
FeO + CO Fe + CO2
b) Luyện kẽm từ quặng blend:
ZnS + O2 ZnO + SO2
ZnO + C Zn + CO
c) Sản xuất xút, chlorine từ dung dịch muối ăn:
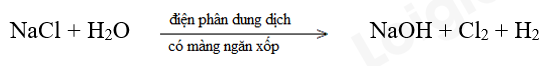
d) Đốt cháy ethanol có trong xăng E5:
C2H5OH + O2 CO2 + H2O
Hãy chỉ ra các phản ứng oxi hóa – khử, lập phương trình hóa học của các phản ứng đó theo phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử.
Phương pháp giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:
Các phản ứng oxi hóa – khử là: a; b; c và d.
a)
* Fe2O3 + CO FeO + CO2
Bước 1:
![]()
Bước 2:
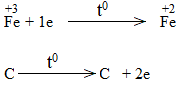
Bước 3:
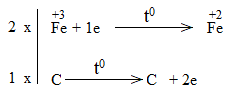
Bước 4:
Fe2O3 + 3CO 2FeO + 3CO2
* FeO + CO Fe + CO2
Bước 1:
Bước 2:
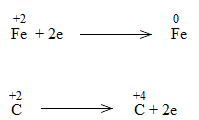
Bước 3:
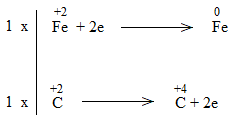
Bước 4:
FeO + CO Fe + CO2
b)
* ZnS + O2 ZnO + SO2
Bước 1:
![]()
Bước 2:
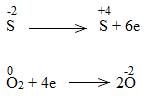
Bước 3:
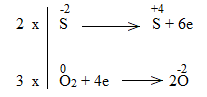
Bước 4:
2ZnS + 3O2 2ZnO + 2SO2
* ZnO + C Zn + CO
Bước 1:
![]()
Bước 2:
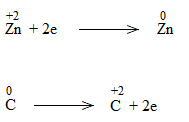
Bước 3:
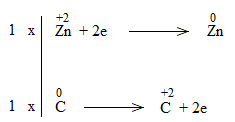
Bước 4:
ZnO + C Zn + CO
c)
Bước 1:
![]()
Bước 2:
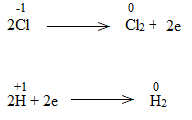
Bước 3:
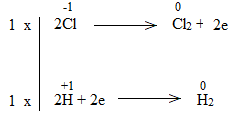
Bước 4:

d)
C2H5OH + O2 CO2 + H2O
Bước 1:
![]()
Bước 2:
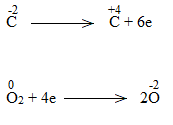
Bước 3:
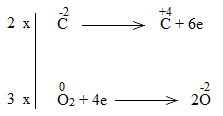
Bước 4:
C2H5OH + 9/2O2 2CO2 + 6H2O
Câu 6 trang 79 Hóa học 10: Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 → NO + H2O
Trong công nghiệp, cần trộn 1 thể tích khí ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khi đo ở cùng điều kiện về nhiệt độ và áp suất.
Phương pháp giải:
Sử dụng phương pháp thăng bằng electron để cân bằng phản ứng => Tỉ lệ phản ứng
4NH3 + 5O2 → 4NO + 6H2O
Lời giải:
4NH3 + 5O2 → 4NO + 6H2O
- Theo tỉ lệ phản ứng, cứ 4 thể tích khí ammonia phản ứng với 5 thể tích khí oxygen
=> 1 thể tích khí ammonia phản ứng với 1,25 thể tích khí oxygen
- Không khí chứa 21% thể tích khí oxygen
=> Thể tích không khí để thực hiện phản ứng với 1 thể tích khí ammonia là 5,95.
Cu + O2 + H2SO4 → CuSO4 + H2O (1)
a) Lập phương trình hóa học của phản ứng (1) theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
b) Copper (II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
Cu + H2SO4 (đặc) CuSO4 + SO2 + H2O (2)
Trong hai cách trên, cách nào sử dụng ít sulfuric acid hơn, cách nào ít gây ô nhiễm môi trường hơn?
Phương pháp giải:
- Chất nhường electron là chất khử
- Chất nhận electron là chất oxi hóa
- Các bước lập phương trình hóa học:
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
Bước 2: Biểu diễn quá trình oxi hóa – khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Lời giải:
a)
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
![]()
Cu: chất khử
O2: chất khử
Bước 2: Biểu diễn quá trình oxi hóa – khử:
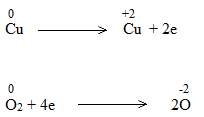
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
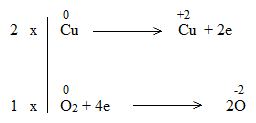
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
b)
Cách 1: 2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
Cứ 1 mol Cu cần dùng 1 mol H2SO4
Cách 2: Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Cứ 1 mol Cu cần dùng 2 mol H2SO4
Theo tỉ lệ phản ứng, cách 1 sử dụng ít sulfuric acid hơn và ít gây ô nhiễm môi trường hơn. Do cách 2 sinh ra khí SO2.
Bài giảng Hóa học 10 Bài 16: Ôn tập chương 4 - Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa - khử
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học