Lời giải bài tập Hóa học lớp 10 Bài 18: Ôn tập chương 5 sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 18 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 18: Ôn tập chương 5
I. Hệ thống hóa kiến thức
Giải hóa học 10 trang 89 Kết nối tri thức
II. Luyện tập
Câu hỏi 1 trang 89 Hóa học 10: Phản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) → P (s, trắng) = 17,6 kJ
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. tỏa nhiệt, P đỏ bền hơn P trắng.
D. tỏa nhiệt, P trắng bền hơn P đỏ.
Phương pháp giải:
Chất phản ứng → Sản phẩm
> 0 ( phản ứng thu nhiệt)
< 0 ( phản ứng tỏa nhiệt)
- Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
Lời giải:
= 17,6 kJ > 0
=> Phản ứng thu nhiệt, nhiệt tạo thành P trắng lớn hơn P đỏ
=> P trắng bền hơn P đỏ
=> Đáp án: B
Câu hỏi 2 trang 89 Hóa học 10: Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện tiêu chuẩn:
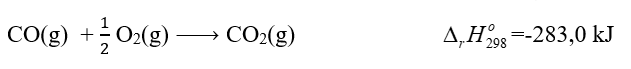
Biết nhiệt tạo thành chuẩn của CO2: (CO2(g)) = - 393,5 kJ/mol
Nhiệt tạo thành chuẩn của CO là:
A. -110,5 kJ/mol
B. +110,5 kJ/mol
C. -141,5 kJ/mol
D. -221,0 kJ/mol
Phương pháp giải:
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
Lời giải:
= (CO2(g)) - (CO(g))
-283,0 = - 393,5 - (CO(g))
=> (CO(g)) = -393,5 + 283 = -110,5 kJ/mol
=> Đáp án A
A. +397,09 kJ.
B.+381,67 kJ.
C. +389,30 kJ.
D. +416,02 kJ.
Phương pháp giải:
Cứ 1 mol glucose được đốt cháy sẽ tỏa ra lượng nhiệt là 2803,0 kJ.
Lời giải:

Giải hóa học 10 trang 90 Kết nối tri thức
Câu hỏi 4 trang 90 Hóa học 10: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:

Biến thiên enthalpy của phản ứng C3H8(g) → CH4(g) + C2H4(g) có giá trị là
A. +103 kJ.
B. -103 kJ.
C. +80 kJ.
D. -80 kJ.
Phương pháp giải:
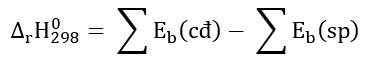
Lời giải:
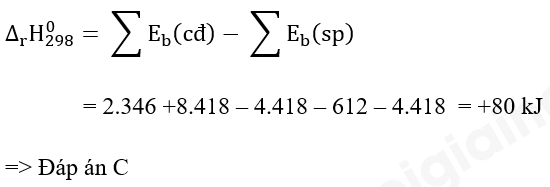
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) = -890,3 kJ
Biến nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là -393,5 và -285,8 kJ/mol.
Hãy tính nhiệt tạo thành chuẩn của khí methane.
Phương pháp giải:
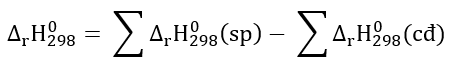
Lời giải:
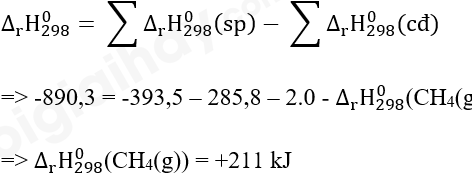
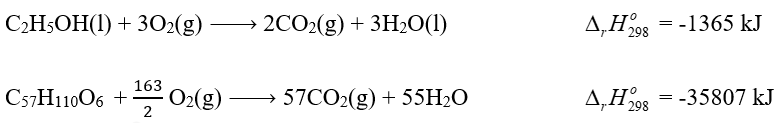
Phương pháp giải:
Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều
Lời giải:

Câu hỏi 7 trang 90 Hóa học 10: Biết CH3COCH3có công thức cấu tạo:
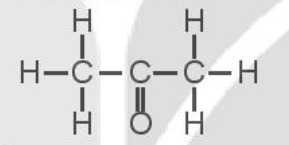
Từ số liệu năng lượng liên kết ở Bảng 12.2, hãy xác định biến thiên enthalpy của phản ứng đốt cháy acetone (CH3COCH3).
CH3COCH3(g) + 4O2(g) → 3CO2(g) + 3H2O (g)
Phương pháp giải:
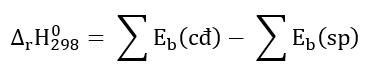
Lời giải:

Cho biết các phản ứng:

Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10 000 kJ nhiệt ( hiệu suất hấp thụ nhiệt là 80%). Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12kg?
Phương pháp giải:
Cứ 1 mol khí propane đốt cháy tỏa 2220 kJ
Cứ 1 mol khí butane đốt cháy tỏa 2874 kJ
Lời giải:
Gọi số mol của propane và butane lần lượt là x và y
2x – y = 0
44x + 58y = 12000
=> x = 75 mol và y = 150 mol
75 mol khí propane đốt cháy tỏa 75 . 2220 = 166500 kJ
150 mol khí butane đốt cháy tỏa 150 . 2874 = 431100 kJ
Tổng lượng nhiệt bình gas 12 kg có thê cung cấp là 166500 + 431100 = 597600 kJ
Một ngày, bình gas cần cung cấp lượng nhiệt thực tế là 10000 : 0,8 = 12500 kJ
Số ngày để hộ gia đình sử dụng hết bình gas 12 kg là: 597600 : 12500 = 48 ngày
Bài giảng Hóa học 10 Bài 18: Ôn tập chương 5 - Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học