Với giải Câu 3 trang 33 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
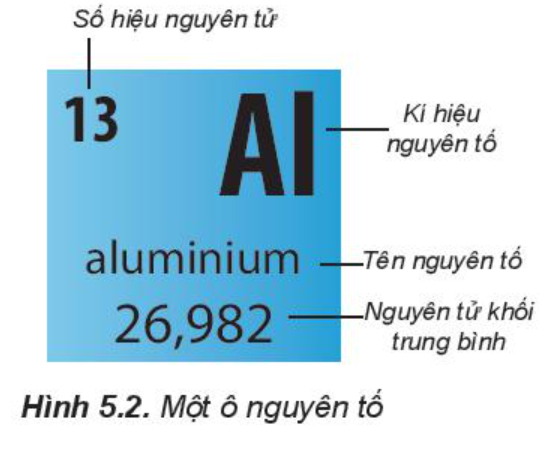
Câu 3 trang 33 Hóa học 10: Ô nguyên tố trong bảng tuần hoàn cho ta biết những thông tin gì? Lấy ví dụ minh họa.
Phương pháp giải:
Ô nguyên tố được mô ta như hình vẽ

Lời giải:
- Trong bảng tuần hoàn, ô nguyên tố cho ta biết: số hiệu nguyên tử, kí hiệu nguyên tố, tên nguyên tố và nguyên tử khối trung bình,…
- Ví dụ: Ô nguyên tố nhôm

- Nhôm có số hiệu nguyên tử là 13
- Kí hiệu nguyên tố là Al
- Tên nguyên tố là nhôm
- Nguyên tử khối trung bình của nhôm là 26,982
Lý thuyết Cấu tạo của bảng tuần hoàn
1. Ô nguyên tố
Trong bảng tuần hoàn, mỗi nguyên tố được xếp vào một ô, gọi là ô nguyên tố. Số thứ tự của ô là số hiệu nguyên tử của nguyên tố đó.
Tùy theo từng loại bảng, các thông tin của một ô nguyên tố có thể là số hiệu nguyên tử, kí hiệu nguyên tố, tên nguyên tố, nguyên tử khối trung bình, …
Ví dụ: Nguyên tử nguyên tố sodium có Z = 11. Nguyên tố sodium ở ô 11 trong bảng tuần hoàn.
2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Bảng tuần hoàn hiện nay có 7 chu kì. Số thứ tự chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì.
Ví dụ: Cấu hình electron của nguyên tử nguyên tố oxygen (Z = 8): 1s22s22p4.
Nguyên tử oxygen có 2 lớp electron.
Số thứ tự chu kì = số lớp electron = 2.
Nguyên tố oxygen thuộc chu kì 2 trong bảng tuần hoàn.
3. Nhóm nguyên tố
Nhóm nguyên tố gồm các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
Bảng tuần toàn hiện nay có 18 cột, chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
Ví dụ: Nhóm kim loại kiềm – nhóm IA, nhóm halogen – nhóm VIIA.
Nguyên tử các nguyên tố trong cùng một nhóm A có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ He).
4. Phân loại nguyên tố
a) Theo cấu hình electron
Các nguyên tố s, p, d, f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s, p, d, f tương ứng.
Ví dụ: 11Na: 1s22s22p63s1 (nguyên tố s).
Các nhóm A: gồm các nguyên tố s và nguyên tố p.
Các nhóm B: gồm các nguyên tố d và nguyên tố f.
b) Theo tính chất hóa học
Các nhóm IA, IIA, IIIA: gồm các nguyên tố s và p là kim loại (trừ H và B).
Các nhóm VA, VIA, VIIA: gồm các nguyên tố p, thường là phi kim.
Nhóm VIIIA: gồm các nguyên tố khí hiếm.
Các nhóm B: gồm các nguyên tố d và f đều là kim loại chuyển tiếp.
Ví dụ: Nguyên tố chlorine có Z = 17. Xác định vị trí của nguyên tố chlorine trong bảng tuần hoàn và cho biết chúng thuộc loại nguyên tố s, p hay d; là kim loại, phi kim hay khí hiếm.
Hướng dẫn giải:
Cấu hình electron của nguyên tử nguyên tố chlorine (Z = 17): 1s22s22p63s23p5.
Số thứ tự ô = số electron = 17.
Số thứ tự chu kì = số lớp electron = 3.
Nguyên tử chlorine có electron cuối cùng điền vào phân lớp p nên chlorine là nguyên tố p và thuộc nhóm A.
Số thứ tự nhóm A = số electron hóa trị = 7 nhóm VIIA.
Vậy, nguyên tố chlorine thuộc ô 17, chu kì 3, nhóm VIIA.
Nguyên tố chlorine thuộc nhóm VIIA Chlorine là nguyên tố phi kim
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Mở đầu trang 30 Hóa học 10: Bảng tuần hoàn các nguyên tố hóa học có cấu tạo như thế nào? Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?...
Câu 1 trang 31 Hóa học 10: Theo tiến trình lịch sử, các nhà khoa học đã phân loại các nguyên tố hóa học dựa trên các cơ sở nào?...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học