Lời giải bài tập Hóa học lớp 10 Bài 4: Ôn tập chương 1 sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 4 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 4: Ôn tập chương 1
Video giải Hóa học 10 Bài 4: Ôn tập chương 1 - Kết nối tri thức
I. Hệ thống hóa kiến thức
Giải hóa học 10 trang 27 Kết nối tri thức
II. Luyện tập
Câu 1 trang 27 Hóa học 10: Số proton, neutron và electron của lần lượt là
A. 19, 20, 39
B. 20, 19, 39
C. 19, 20, 19
D. 19, 19, 20
Phương pháp giải: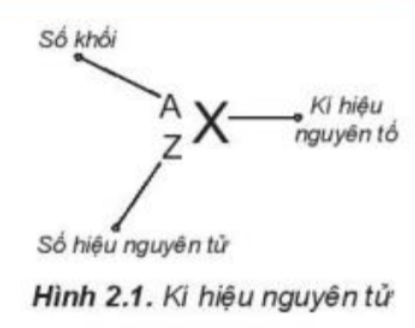
- Kí hiệu một nguyên tử cho biết:
+ Kí hiệu của nguyên tố đó
+ Số hiệu nguyên tử = số proton = số electron
+ Số neutron = số khối – số proton
Lời giải:
Nguyên tử cho biết:
+ Số hiệu nguyên tử = số proton = số electron = 19
+ Số khối = 39 => Số neutron = 39 – 19 = 20
=> Số proton, neutron và electron của lần lượt là 19, 20, 19
Câu 2 trang 27 Hóa học 10: Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng
A.
B.
C.
D.
Phương pháp giải:
Bước 1: Số hiệu nguyên tử = số electron của nguyên tử đó
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng:
1s 2s 2p 3s 3p 4s 3d…
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
Lời giải:
có Z = 11 => Có 11 electron: 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng (lớp 3)
có Z = 7 => Có 7 electron: 1s22s22p3 => Có 5 electron ở lớp ngoài cùng (lớp 2)
có Z = 13 => Có 13 electron: 1s22s22p63s23p1 => Có 3 electron ở lớp ngoài cùng (lớp 3)
có Z = 6 => Có 6 electron: 1s22s22p2 => Có 4 electron ở lớp ngoài cùng (lớp 2)
=> có 3 electron thuộc lớp ngoài cùng
Đáp án C
A. 8
B. 9
C. 11
D. 10
Phương pháp giải:
Bước 1: Viết cấu hình electron của potassium có 19 electron với thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d…
Bước 2: Viết cấu hình orbital chứa electron
=> Số orbital chứa electron
Lời giải:
Nguyên tử potassium có 19 electron => Cấu hình electron: 1s22s22p63s23p64s1 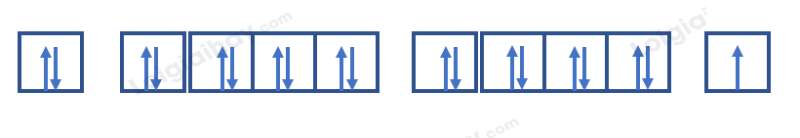
=> Có 10 orbital chứa electron
Đáp án D
Câu 4 trang 27 Hóa học 10: Nguyên tử của nguyên tố sodium (natri) (Z = 11) có cấu hình electron là
A. 1s22s22p63s2
B. 1s22s22p6
C. 1s22s22p63s1
D. 1s22s22p53s2
Phương pháp giải:
- Viết cấu hình electron của sodium có 11 electron với thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d…
- Lưu ý: Điền đủ electron vào mức năng lượng thấp rồi mới đến năng lượng cao (s có 2, p có 6, d có 10, f có 14)
Lời giải:
Nguyên tử sodium có 11 electron => Cấu hình electron: 1s22s22p63s1
Đáp án C
Phương pháp giải:
- Trong nguyên tử
+ Hạt mang điện là hạt proton và electron
+ Hạt không mang điện là hạt neutron
+ Số proton = Số electron
B1: Xác định số proton, neutron và electron trong nguyên tử X
B2: Dựa vào số proton trong nguyên tử X => X là nguyên tố nào
Lời giải:
- Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p, e, n
- Nguyên tử X có tổng số hạt proton, neutron và electron là 58:
=> p + e + n = 58 (1)
- Số hạt mang điện nhiều hơn số hạt không mang điện là 18:
=> p + e – n = 18 (2)
- Mà p = e (3)
- Từ (1), (2), (3) => p = e = 19 và n = 20
Vậy X là Kali
Phương pháp giải:
- Trong nguyên tử, các e được sắp xếp thành từng lớp, các lớp được sắp xếp từ gần hạt nhân ra ngoài. Các e có năng lượng gần bằng nhau được sắp xếp trên cùng 1 lớp
- Electron độc thân là electron đứng một mình trong orbital nguyên tử mà không hình thành cặp electron
Lời giải:
- Nguyên tố chlorine có Z = 17 => Có 17 electron
- Cấu hình e: 1s22s22p63s23p5
- Biểu diễn cấu hình chlorine theo ô orbital: 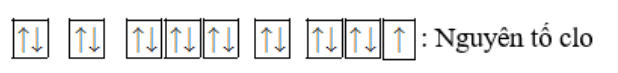
- Nguyên tố Chlorine có:
+ Số lớp electron: 3
+ Số electron thuộc lớp ngoài cùng: 7
+ Số electron độc thân: 1
Phương pháp giải:
- Nguyên tử khối trung bình của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
- Nguyên tử khối trung bình:
M = aA+bB+cC+dD+… /100
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
Gọi số khối đồng vị còn lại là x. Ta có:
(50.0,25 + 99,75.x)/100 = 50.9975
=> x = 51
Vậy số khối đồng vị còn lại của vanadi là 51
Câu 8 trang 27 Hóa học 10: Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1
- Nguyên tử Y: 1s22s22p63s23p4
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Phương pháp giải:
a) Số electron của nguyên tử bằng tổng số electron trên các phân lớp s, p, d, f có trong cấu hình electron.
b) Số hiệu nguyên tử (Z) hay còn gọi là số proton => Số hiệu nguyên tử = số electron.
c) Những e ở lớp trong liên kết với hạt nhân bền chặt hơn những e ở lớp ngoài. Năng lượng của e lớp trong thấp hơn năng lượng e ở lớp ngoài.
d)
- Lớp electron được đánh số từ 1 đến 7 hoặc kí hiệu tương ứng là K, L, M, N, O, P, Q.
- Phân lớp electron gồm 4 loại kí hiệu là s, p, d, f.
e) Nguyên tố có:
+ 1,2,3 e lớp ngoài cùng là kim loại (trừ H, He)
+ 5,6,7 e lớp ngoài cùng là phi kim.
+ 8 e lớp ngoài cùng là khí hiếm (trừ He có 2e lớp ngoài cùng nhưng vẫn là khí hiếm).
+ 4 e ngoài cùng ở chu kì 2,3 là phi kim, còn ở các chu kì khác kim loại.
Lời giải:
a)
- Tổng số e trên các phân lớp của nguyên tử X là 19 => Nguyên tử X có 19 e
- Tổng số e trên các phân lớp của nguyên tử Y là 16 => Nguyên tử X có 16 e
b)
- Nguyên tử X có 19 e => Nguyên tử X có số hiệu nguyên tử ZX = 19
- Nguyên tử Y có 16 e => Nguyên tử Y có số hiệu nguyên tử ZY = 16
c)
- Trong nguyên tử X lớp electron ở mức năng lượng cao nhất là lớp N (n=4)
- Trong nguyên tử Y lớp electron ở mức năng lượng cao nhất là lớp M (n=3)
d)
- Nguyên tử X có:
+ 4 lớp electron (n = 1, 2, 3, 4)
+ 6 phân lớp electron (gồm 1s, 2s, 2p, 3s, 3p, 4s)
- Nguyên tử Y có:
+ 3 lớp electron (n= 1, 2, 3)
+ 5 phân lớp electron (gồm 1s, 2s, 2p, 3s, 3p)
e)
- Nguyên tử X có 1 e lớp ngoài cùng (4s1) => X là nguyên tố kim loại.
- Nguyên tử Y có 6 e lớp ngoài cùng (3s23p4) => Y là nguyên tố phi kim.
Phương pháp giải:
Ta có cấu hình electron kết thúc => cấu hình electron nguyên tử => số electron trong nguyên tử.
Dựa vào cấu hình electron => số e lớp ngoài cùng => tính kim loại/phi kim.
Lời giải:
- Nguyên tử nguyên tố X có e cuối cùng điền vào phân lớp 3p1
→ X có cấu hình e: 1s22s22p63s23p1 → X có 13 e và X là nguyên tố kim loại (vì có 3 e lớp ngoài cùng 3s23p1)
- Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3
→ Y có cấu hình e: 1s22s22p63s23p3 → Y có 15 e và Y là nguyên tố phi kim (vì có 5 e lớp ngoài cùng 3s23p3 ).
Phương pháp giải:
Trong nguyên tử : proton và electron mang điện, neutron không mang điện.
Tổng số hạt = số proton + số electron + số neutron = 2Z + N (do số proton = số electron)
Số khối A = số proton + số neutron = Z + N
Lời giải:
Ta có Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49:
=> 2Z + N = 49 (1)
Lại có, số hạt không mang điện bằng 53,125% số hạt mang điện:
=>N = 2Z x 53,125% = 1716Z
<=>17Z – 16N = 0 (2)
Từ (1) & (2) ta có: 2Z + N = 49
17Z – 16N = 0
=> Z=16 N =17
Vậy nguyên tử nguyên tố X có : điện tích hạt nhân là 16+, 16 proton, 16 electron, 17 neutron và có số khối là 33.
Bài giảng Hóa học 10 Bài 4: Ôn tập chương 1 - Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì