Lời giải bài tập Hóa học lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 6 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Video giải Hóa học 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm - Kết nối tri thức
Giải hóa học 10 trang 34 Kết nối tri thức
Phương pháp giải:
- Trong một chu kỳ
+ đối với nguyên tử: bán kính giảm dần, số electron hóa trị và độ âm điện tăng dần
+ đối với đơn chất: tính kim loại giảm dần, tính phi kim tăng dần
- Trong một nhóm:
+ đối với nguyên tử: bán kính và số lớp electron tăng dần, độ âm điện giảm dần
+ đối với đơn chất: tính kim loại tăng dần và phi kim giảm dần
Lời giải:
- Trong một chu kì, khi đi từ trái sang phải:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần.
+ Số electron hóa trị của nguyên tử các nguyên tố nhóm A tăng lần lượt từ 1 đến 8
- Trong một nhóm A, khi đi từ trên xuống dưới:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần
+ Tính kim loại tăng dần và tính phi kim giảm dần.
+ Số lớp electron của nguyên tử các nguyên tố tăng dần
Giải hóa học 10 trang 35 Kết nối tri thức
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
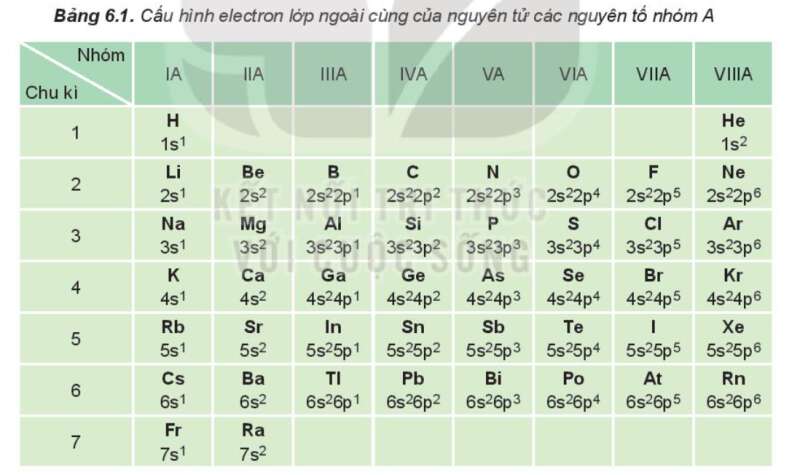
Phương pháp giải:
Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng ( electron hóa trị) bằng nhau. => Số thứ tự nhóm bằng số electron lớp ngoài cùng của nguyên tử.
Lời giải:
Trong bảng 6.1, nguyên tố:
+ Li nằm ở nhóm IA => Li có 1 electron lớp ngoài cùng.
+ Al nằm ở nhóm IIIA => Al có 3 electron lớp ngoài cùng.
+ Ar nằm ở nhóm VIIIA => Ar có 8 electron lớp ngoài cùng.
+ Ca nằm ở nhóm IIA => Ca có 2 electron lớp ngoài cùng.
+ Si nằm ở nhóm IVA => Si có 4 electron lớp ngoài cùng.
+ Se nằm ở nhóm VIA => Se có 6 electron lớp ngoài cùng.
+ Br nằm ở nhóm VIIA => Br có 7 electron lớp ngoài cùng.
Phương pháp giải:
Z là số hiệu nguyên tử của các nguyên tố. Số hiệu nguyên tử bằng số thứ tự của nguyên tố trong bảng tuần hoàn hóa học.
Lời giải:
Z = 8 => Nguyên tố nằm ở ô số 8, chu kì 2, nhóm VIA => Có 6 electron hóa trị.
Z = 11 => Nguyên tố nằm ở ô số 11, chu kì 3, nhóm IA => Có 1 electron hóa trị.
Z = 17 => Nguyên tố nằm ở ô số 17, chu kì 3, nhóm VIIA => Có 7 electron hóa trị.
Z = 20 => Nguyên tố nằm ở ô số 20, chu kì 4, nhóm IIA => Có 2 electron hóa trị.
Giải hóa học 10 trang 36 Kết nối tri thức
II. Bán kính nguyên tử
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium ( Z = 34)
Phương pháp giải:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
Lời giải:
a) Lithium và potassium nằm cùng một nhóm IA trong bảng tuần hoàn.
=> Bán kính nguyên tử của lithium nhỏ hơn bán kính nguyên tử của potassium.
b) Calcium và selenium nằm cùng một chu kì 4 trong bảng tuần hoàn.
=> Bán kính nguyên tử của calcium lớn hơn bán kính nguyên tử của selenium.
Giải hóa học 10 trang 37 Kết nối tri thức
III. Độ âm điện
Phương pháp giải:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
Lời giải:
- Ca (Z =20), Mg (Z = 12), P (Z = 15) và S (Z = 16) cùng nằm ở chu kì 2
- Trong một chu kì, khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử các nguyên tố hóa học có trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
Phương pháp giải:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
Lời giải:
a) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => bán kính nguyên tử tăng dần theo thứ tự: Si, Al, Mg.
b) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => độ âm điện của các nguyên tố theo thứ tự giảm dần: Si, Al, Mg.
Giải hóa học 10 trang 39 Kết nối tri thức
IV. Tính kim loại và tính phi kim
Phương pháp giải:
Trong một nhóm, tính kim loại tăng theo chiều tăng của điện tích hạt nhân.
Lời giải:
- Trong một nhóm, tính kim loại tăng theo chiều tăng của điện tích hạt nhân.
- Các nguyên tố Ba, Mg, Ca và Sr đều nằm ở nhóm IIA => Các nguyên tố được sắp xếp theo thứ tự giảm dần tính kim loại Ba, Sr, Ca, Mg.
Câu 7 trang 39 Hóa học 10: Trong các nguyên tố O, F, Cl Se, nguyên tố có tính phi kim mạnh nhất là
A. O.
B. F.
C. Se.
D. Cl.
Phương pháp giải:
- Trong một nhóm, tính kim loại tăng và tính phi kim giảm theo chiều tăng của điện tích hạt nhân.
- Trong một chu kì, tính kim loại giảm và tính phi kim tăng theo chiều tăng của điện tích hạt nhân.
Lời giải:
- Nguyên tố O và F nằm cùng một chu kì 2 => tính phi kim theo thứ tự tăng dần O, F
- Nguyên tố O và Se nằm cùng một nhóm => tính phi kim theo thứ tự tăng dần Se, O
- Nguyên tố F và Cl nằm cùng một nhóm => tính phi kim theo thứ tự tăng dần Cl, F
=> Nguyên tố có tính phi kim mạnh nhất trong các nguyên tố O,F, Cl, Se là F
Lý thuyết Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Nguyên tử các nguyên tố nhóm A (gồm các nguyên tố s và p) có số electron lớp ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn ® là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
II. Bán kính nguyên tử.
Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng là do lực hút giảm.
Xu hướng biến đổi bán kính nguyên tử:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
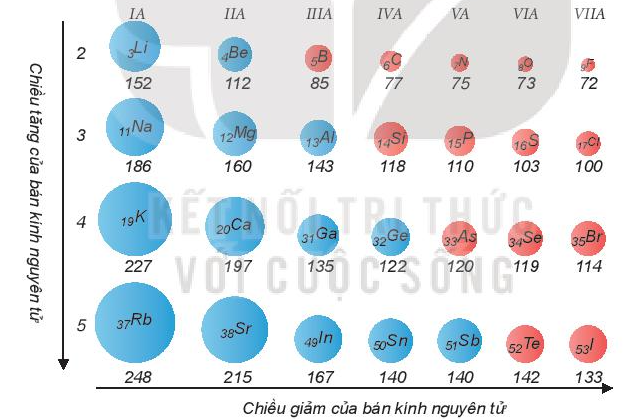 Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Hướng dẫn giải:
Cấu hình electron của nguyên tử:
Lithium (Z = 3): 1s22s1 Lithium thuộc chu kì 2, nhóm IA.
Potassium (Z = 19): 1s22s22p63s23p64s1 Potassium thuộc chu kì 4, nhóm IA.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Bán kính của nguyên tử lithium nhỏ hơn bán kính nguyên tử potassium.
III. Độ âm điện
Độ âm điện của nguyên tử (c) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
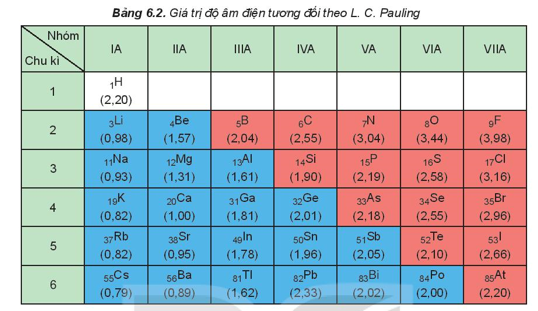
Ví dụ: Cho nguyên tử các nguyên tố: X (Z = 11); Y (Z = 13); T (Z = 17). So sánh độ âm điện của X, Y, T.
Hướng dẫn giải:
Cấu hình electron của nguyên tử các nguyên tố:
X (Z = 11): 1s22s22p63s1 X nằm ở ô số 11, chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 Y nằm ở ô số 13, chu kì 3, nhóm IIIA.
T (Z = 17): 1s22s22p63s23p5 T nằm ở ô số 17, chu kì 3, nhóm VIIA.
X, Y, T đều thuộc chu kì 3.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
So sánh độ âm điện: X < Y < T.
IV. Tính kim loại và tính phi kim
1. Khái niệm
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành ion âm, tính phi kim của nguyên tố đó càng mạnh.
2. Sự biến đổi tính kim loại, tính phi kim
Xu hướng biến đổi tính kim loại và tính phi kim:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
Ví dụ 1:

Ví dụ 2: Cho nguyên tử các nguyên tố X (Z = 9), Y (Z = 15), T (Z = 17). So sánh tính phi kim của X, Y, T.
Hướng dẫn giải:
Cấu hình electron nguyên tử:
X (Z = 9): 1s22s22p5 X thuộc chu kì 2, nhóm VIIA.
Y (Z = 15): 1s22s22p63s23p3 Y thuộc chu kì 3, nhóm VA.
T (Z = 17): 1s22s22p63s23p5 T thuộc chu kì 3, nhóm VIIA.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng tăng dần.
Tính phi kim: Y < T (Y, T cùng thuộc chu kì 3).
Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng giảm dần.
Tính phi kim: X > T (X, T cùng thuộc nhóm VIIA).
Vậy: Tính phi kim tăng dần là Y < T < X.
Bài giảng Hóa học 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố - Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học