Với giải Luyện tập trang 75 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Luyện tập trang 75 Hóa học 10: Cho phương trình hóa học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3 2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó
Phương pháp giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
- Quá trình oxi hóa là quá trình nhường electron
- Quá trình khử là quá trình nhận electron
Lời giải:
- Xét phản ứng (1):
+ Là phản ứng oxi hóa – khử vì nguyên tử S và Br có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: S-2 → S0 + 2e
+ Quá trình khử: Br20 + 2e → Br-1
- Xét phản ứng (2):
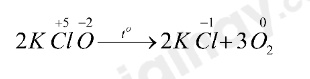
+ Là phản ứng oxi hóa – khử vì nguyên tử Cl và O có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: 2O-2 → O20 + 4e
+ Quá trình khử: Cl+5 + 6e → Cl-1
- Xét phản ứng (3): CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
+ Không phải phản ứng oxi hóa – khử vì các nguyên tử không có sự thay đổi số oxi hóa
Lý thuyết Phản ứng oxi hóa – khử
- Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay phản ứng có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Chất khử (hay chất bị oxi hóa) là chất nhường electron hay chất có số oxi hóa tăng lên sau phản ứng.
- Chất oxi hóa (hay chất bị khử) là chất nhận electron hay chất có số oxi hóa giảm xuống sau phản ứng.
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình nhận electron.
- Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời sự oxi hóa và sự khử.
Ví dụ: Xét phương trình hóa học:
+ ion S2- nhường electron (số oxi hóa tăng) nên là chất khử.
+ Br nhận electron nên là chất oxi hóa.
+ Quá trình nhường electron là quá trình oxi hóa:
+ Quá trình nhận electron là quá trình khử:
Chú ý:
+ Chất oxi hóa mạnh thường là các hợp chất chứa nguyên tử của các nguyên tố có số oxi hóa cao (như ) hoặc đơn chất của các nguyên tố có độ âm điện lớn (như F2, O2, Cl2, Br2, …)
+ Chất khử mạnh thường là các hợp chất chứa nguyên tử của các nguyên tố có số oxi hóa thấp (như ) hoặc đơn chất kim loại (như kim loại kiềm, kiềm thổ, …)
+ Chất chứa nguyên tử của nguyên tố có số oxi hóa trung gian (như thì tùy thuộc vào điều kiện phản ứng (tác nhân và môi trường) mà thể hiện tính khử hoặc tính oxi hóa hoặc cả hai (vừa tính oxi hóa, vừa tính khử hay tự oxi hóa – khử).
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 3 trang 79 Hóa học 10: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa - khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng