Với giải Câu hỏi 1 trang 72 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
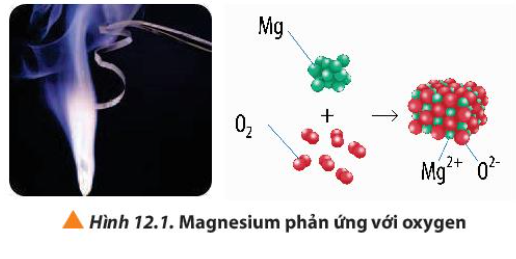
Câu hỏi 1 trang 72 Hóa học 10: Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen
Phương pháp giải:
- O tham gia quá trình nhận electron
- Mg tham gia quá trình nhường electron
Lời giải:
- O tham gia quá trình nhận electron
O + 2e → O2-
- Mg tham gia quá trình nhường electron
Mg → Mg2+ + 2e
Lý thuyết Số oxi hóa
1. Tìm hiểu về số oxi hóa
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Ví dụ: Giả định nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron.
⇒ Cl mang điện tích -1 và H mang điện tích +1.
⇒ Ta nói số oxi hóa của Cl là -1, của H là +1.
- Cách biểu diễn số oxi hóa: Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
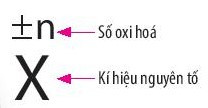
Ví dụ:
2. Xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Quy tắc xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0.
Ví dụ:
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
Ví dụ: Tổng số oxi hóa của các nguyên tử trong phân tử NH3 là: (-3) × 1 + 3 × (+1) = 0.
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với các ion đa nguyên tử) bằng điện tích của ion đó.
Ví dụ: Số oxi hóa của nguyên tử Na trong ion Na+ là +1.
Trong ion HSO4- tổng số oxi hóa của các nguyên tử: 1.(+1) + 1.(+6) + 4.(-2) = -1
- Quy tắc 4: Trong đa số các hợp chất, số oxi hóa của hydrogen là +1, trừ các hydride kim loại như NaH, CaH2 …. Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide; superoxide (như H2O2; Na2O2; KO2 …). Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1; kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm có số oxi hóa +3. Số oxi hóa của các nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.
|
Xác định số oxi hóa |
Số oxi hóa |
|
Đơn chất |
0 |
|
Phân tử |
Tổng số oxi hóa của các nguyên tử bằng 0 |
|
Ion đơn nguyên tử |
Bằng điện tích của ion |
|
Ion đa nguyên tử |
Tổng số oxi hóa các nguyên tử bằng điện tích ion |
|
Ion fluorine |
-1 |
|
Oxygen trong hợp chất (trừ OF2 và các peroxide, superoxide) |
-2 |
|
Hydrogen trong hợp chất (trừ các hydride) |
+1 |
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 3 trang 79 Hóa học 10: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa - khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng