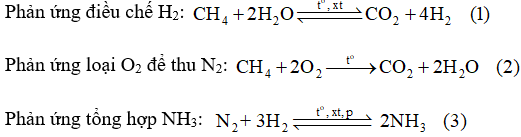Với giải Bài 4.16 trang 21 SBT Hóa Học lớp 11 Chân trời sáng tạo chi tiết trong Bài 4: Ammonia và một số hợp chất ammonium giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa Học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 4: Ammonia và một số hợp chất ammonium
Bài 4.16 trang 21 SBT Hóa học 11: Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
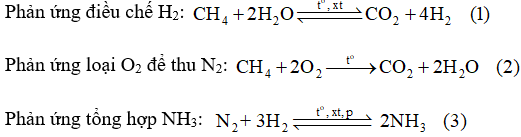
Để sản xuất khí ammonia, nếu lấy 841,7 m3 không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích), thì cần phải lấy bao nhiêu m3 khí methane và bao nhiêu m3 hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
Lời giải:
Theo phương trình hóa học (2):
Theo phương trình hóa học (3):
Theo phương trình hóa học (1):
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 4.1 trang 18 SBT Hóa học 11: Liên kết trong phân tử NH3 là...
Bài 4.2 trang 18 SBT Hóa học 11: Trong dung dịch, ammonia thể hiện tính base yếu do...
Bài 4.3 trang 18 SBT Hóa học 11: Để tạo độ xốp cho một số loại bánh, có thể dùng chất nào sau đây?...
Bài 4.4 trang 18 SBT Hóa học 11: Cho hỗn hợp khí (X) gồm N2, H2, NH3 có tỉ khối so với khí hydrogen là 8. Dẫn hỗn hợp khí (X) đi qua dung dịch H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần % theo thể tích mỗi khí trong hỗn hợp (X) lần lượt là...
Bài 4.5 trang 18 SBT Hóa học 11: Trong các phát biểu sau, phát biểu nào không đúng?...
Bài 4.6 trang 18 SBT Hóa học 11: Trong phòng thí nghiệm, người ta có thể phân biệt muối ammonium với một số muối khác bằng cách cho nó tác dụng với dung dịch base. Hiện tượng nào xảy ra?...
Bài 4.7 trang 19 SBT Hóa học 11: Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?...
Bài 4.8 trang 19 SBT Hóa học 11: Cho các phát biểu sau:...
Bài 4.9 trang 19 SBT Hóa học 11: Tã lót trẻ em sau khi được giặt sạch vẫn còn mùi khai do vẫn lưu lại một lượng ammonia. Để khử hoàn toàn mùi của ammonia thì người ta cho vào nước xả cuối cùng một ít hoá chất có sẵn trong nhà. Hãy chọn hóa chất thích hợp:...
Bài 4.10 trang 19 SBT Hóa học 11: Trong khí thải của quy trình sản xuất thuốc trừ sâu, phân bón hoá học có lẫn khí NH3. Khí này rất độc đối với sức khoẻ của con người và gây ô nhiễm môi trường. Con người hít phải khí này với lượng lớn sẽ gây ngộ độc: họ, đau ngực (nặng), đau thắt ngực, khó thở, thở nhanh, thở khò khè; chảy nước mắt và bỏng mắt, mù mắt, đau họng nặng, đau miệng; mạch nhanh, yếu, sốc; lẫn lộn, đi lại khó khăn, chóng mặt, thiếu sự phối hợp, bồn chồn, ngẩn ngơ). Để xử lí NH3 lẫn trong khí thải, người ta có thể dẫn khí thải qua một bể lọc chứa hoá chất nào sau đây?...
Bài 4.11 trang 20 SBT Hóa học 11: Khi phun NH3 vào không khí bị nhiễm Cl2 thấy xuất hiện “khói trắng”. Giải thích và viết phương trình hoá học minh hoạ...
Bài 4.12 trang 20 SBT Hóa học 11: Cho một ít chất chỉ thị phenolphtalein vào dung dịch NH3 loãng thu được dung dịch (A). Màu của dung dịch (A) thay đổi như thế nào khi...
Bài 4.13 trang 20 SBT Hóa học 11: Xét phản ứng tổng hợp ammonia theo phương trình hoá học:...
Bài 4.14* trang 20 SBT Hóa học 11: Một lượng lớn ammonium ion trong nước rác thải sinh ra khi vứt bỏ vào ao hồ được vi khuẩn oxi hoá thành nitrate và quá trình đó làm giảm oxygen hòa tan trong nước gây ngạt cho sinh vật sống dưới nước. Người ta có thể xử lí nguồn gây ô nhiễm đó bằng nước vôi trong (dung dịch Ca(OH)2) và khí chlorine để chuyển ammonium ion thành ammonia rồi chuyển tiếp thành nitrogen không độc thải ra môi trường. Giải thích cách làm này bằng phương trình hoá học...
Bài 4.15 trang 21 SBT Hóa học 11: Muối NH4NO3 sẽ nhiệt phân theo phản ứng nào trong 2 phản ứng sau?...
Bài 4.16 trang 21 SBT Hóa học 11: Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên)...
Bài 4.17 trang 21 SBT Hóa học 11: Hợp chất có công thức hoá học NH4NO3 được giới chức quốc gia Lebanon xác định là nguyên nhân gây ra vụ nổ thảm khốc ở thủ đô Beirut vào ngày 04/08/2020. Tia lửa hàn trong quá trình sửa chữa nhà kho có thể đã làm 2 750 tấn NH4NO3 cất trữ phát nổ, phá huỷ nhiều nhà cửa, dẫn đến nhiều người thiệt mạng. Hãy giải thích vì sao NH4NO3 có khả năng phát nổ...
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 3: Đơn chất nitrogen
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate