Với giải sách bài tập Hóa học 11 Bài 3: Đơn chất nitrogen sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 3: Đơn chất nitrogen
Bài 3.1 trang 16 SBT Hóa học 11: Ở trạng thái tự nhiên, nitrogen
A. tồn tại ở dạng đơn chất và hợp chất.
B. chỉ tồn tại ở dạng đơn chất.
C. chỉ tồn tại ở dạng hợp chất.
D. tự do chiếm khoảng 20% thể tích không khí.
Lời giải:
Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
→ Chọn A.
Bài 3.2 trang 16 SBT Hóa học 11: Cấu hình electron nguyên tử của nitrogen là
A. 1s22s22p1.
B. 1s22s22p5.
C. 1s22s22p4.
D. 1s22s22p3.
Lời giải:
N (Z = 7): 1s22s22p3
→ Chọn D.
Bài 3.3 trang 16 SBT Hóa học 11: Tính chất nào sau đây của nitrogen không đúng?
A. Ở điều kiện thường, nitrogen là chất khí.
B. Nitrogen tan rất ít trong nước.
C. Nitrogen không duy trì sự cháy và sự hô hấp.
D. Nitrogen nặng hơn không khí.
Lời giải:
→ Chọn D.
Bài 3.4 trang 16 SBT Hóa học 11: Nitrogen trong không khí có vai trò nào sau đây?
A. Cung cấp đạm tự nhiên cho cây trồng.
B. Hình thành sấm sét.
C. Tham gia quá trình quang hợp của cây.
D. Tham gia hình thành mây.
Lời giải:
Trong không khí, nitrogen cung cấp đạm tự nhiên cho cây trồng.
→ Chọn A.
b) Tại sao nitrogen phản ứng được với nhiều kim loại, nhưng trong vỏ Trái Đất không gặp một nitride (N3-) kim loại nào cả?
Lời giải:
a) Nitrogen là phi kim mạnh, nhưng đơn chất nitrogen hoạt động hoá học kém ở nhiệt độ thường, tồn tại được trong tự nhiên (khí quyển) vì phân tử N2 có liên kết ba (N≡N) rất bền, không thể phân huỷ thành nguyên tử khi ở nhiệt độ thấp hoặc không có xúc tác.
b) N2 phản ứng với nhiều kim loại (với Li ở nhiệt độ thường và với Ca, Mg ở nhiệt độ cao) tạo ra các nitride kim loại (Li3N, Ca3N2, Mg3N2...). Thời kì đầu hình thành, Trái Đất rất nóng, tạo điều kiện cho nitrogen có thể tạo nitride với kim loại mạnh. Nhưng ở nhiệt độ này hydrogen và oxygen cũng đã hoá hợp với nhau tạo thành nước. Khi có mặt nước, các nitride kim loại đều bị thuỷ phân thành base kiềm và ammonia.
Ví dụ: Ca3N2 +6H2O → 2NH3 + 3Ca(OH)2
Vì lí do trên nên vỏ Trái Đất không tồn tại các hợp chất nitride kim loại.
Bài 3.6 trang 17 SBT Hóa học 11: Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.
Lời giải:
Lời giải:
Ban đầu (mol): 0,5 1,5 0
Phản ứng (mol): 0,1 ← 0,3 ← 0,2
Cân bằng (mol): 0,4 1,2 0,2
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
Lời giải:
+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
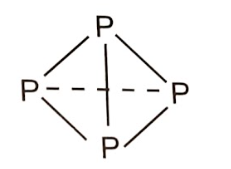
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
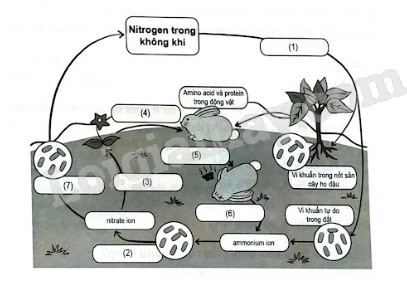
Lời giải:
(1) Quá trình cố định đạm.
(2) Quá trình nitrate hóa bởi vi khuẩn.
(3) Quá trình hấp thu đạm của rễ cây.
(4) Động vật sử dụng thức ăn là thực vật.
(5) Động vật chết.
(6) Quá trình phân hủy xác động vật.
(7) Quá trình khử nitrogen.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Lý thuyết Đơn chất nitrogen
1. Trạng thái tự nhiên
- Ở trạng thái tự nhiên, nitrogen tồn tại ở hai dạng:
+ Dạng đơn chất: Nitrogen chiếm khoảng 78% thể tích của không khí. Là hỗn hợp của hai đồng vị: 147N (99,63%) và 157N (0,37%)
+ Dạng hợp chất:
- Nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) - gọi là diêm tiêu natri.
- Nitrogen còn có trong thành phần của protein, nucleic acid,… và nhiều hợp chất hữu cơ khác
2. Tính chất vật lí
- Ở điều kiện thường:
+ Là chất khí không màu, không mùi, không vị, nhẹ hơn không khí
+ Hóa lỏng ở - 196 độ C, hóa rắn ở - 210 độ C
+ Ít tan trong nước
+ Không duy trì sự cháy và hô hấp.
3. Tính chất hóa học
- Ở điều kiện thường:
+ Phân tử Nitrogen rất bền, khá trơ
+ Nitrogen thể hiện tính oxi hóa, tính khử khi tác dụng với oxigen
Ví dụ:
N2 + 3H2 ⇌ 2NH3 (nhiệt độ, P, chất xúc tác)
N2 + O2 ⇌ 2NO (nhiệt độ)
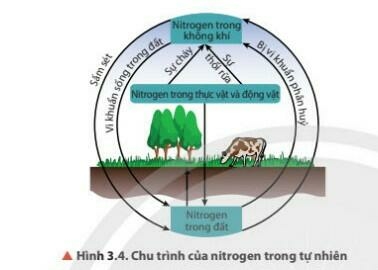
4. Quá trình tạo và cung cấp Nitrogen cho đất từ nước mưa
- Nguyên tố Nitrogen rất cần thiết cho sự sống trên Trái Đất
- Nitrogen chuyển hóa từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín
5. Ứng dụng
- Nitrogen là một trong những nguyên tố dinh dưỡng dính của thực vật
- Trong công nghiệp:
+ Nitrogen dùng để tổng hợp ammonia để sản xuất phân đạm, natric acid,…
+ Nitrogen sử dụng làm môi trường trơ cho các ngành công nghiệp: luyện kim, thực phẩm,...
+ Nitrogen lỏng dùng để bảo quản máu và mẫu sinh vật khác