Với giải sách bài tập Hóa học 11 Bài 5: Một số hợp chất với oxygen của nitrogen sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 5.1 trang 22 SBT Hóa học 11: Hiện tượng mưa acid
A. là hiện tượng sẵn có trong tự nhiên.
B. xảy ra do sự bốc hơi của nước rồi ngưng tụ.
C. xảy ra khi nước mưa có pH < 7.
D. xảy ra khi nước mưa có pH < 5,6.
Lời giải:
Hiện tượng mưa acid xảy ra khi nước mưa có pH < 5,6.
→ Chọn D.
A. SO2, NO, NO2.
B. NO, CO, CO2.
C. CH4, HCl, CO.
D. Cl2, CH4, SO2.
Lời giải:
Hiện tượng mưa acid là do không khí bị ô nhiễm bởi các khí SO2, NO, NO2.
→ Chọn A.
Bài 5.3 trang 22 SBT Hóa học 11: Cho phản ứng: Fe3O4 + HNO3→ Fe(NO3)3 + NO↑ + H2O
Hệ số tỉ lượng của HNO3 trong phương trình hoá học trên là
A. 4.
B. 1.
C. 28.
D. 10.
Lời giải:
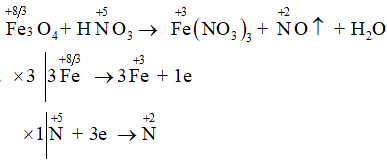
Phương trình: 3Fe3O4 + 28HNO3→ 9Fe(NO3)3 + NO↑ + 14H2O
→ Chọn C.
Bài 5.4 trang 22 SBT Hóa học 11: Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO↑ + eH2O
Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng
A. 3.
B. 5.
C. 4.
D. 6.
Lời giải:
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
→ Chọn B.
A. Fe, Mn.
B. N, P.
C. Ca, Mg.
D. Cl, F.
Lời giải:
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố nitrogen, phosphorus trong nước.
→ Chọn B.
Lời giải:
Có rất nhiều biện pháp để giảm thiểu tác hại của mưa acid, trong đó vấn đề cốt lõi nhất là ý thức của con người.
Một số giải pháp có thể kể đến như:
- Không sử dụng nước mưa trong sinh hoạt hằng ngày.
- Xây dựng quy trình xử lí khí thải.
- Kiểm soát lượng khí thải của phương tiện giao thông, phương tiện vận hành bằng động cơ nhằm làm giảm lượng khí thải có chứa các oxide của nitrogen.
- Loại bỏ triệt để nitrogen, lưu huỳnh có trong than đá và dầu mỏ trước khi đưa vào sử dụng.
- Chuyển sang xu hướng sử dụng các loại năng lượng, nhiên liệu thân thiện với môi trường.
- Giáo dục, tuyên truyền nhằm giúp người dân có ý thức hơn trong việc bảo vệ môi trường.
Lời giải:
Nitric acid tinh khiết kém bền. Dưới tác dụng của ánh sáng, một phần nitric acid bị phân hủy tạo thành nitrogen dioxide.
Lời giải:
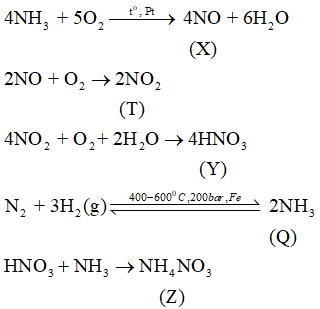
|
Tên quá trình |
Thứ tự |
|
Thực vật chết. |
? |
|
Thiếu oxygen. |
? |
|
Thiếu ánh sáng mặt trời và oxygen nên tảo, thực vật và cá chết. |
? |
|
Vi khuẩn phát triển |
? |
|
Chất dinh dưỡng rửa trôi xuống ao, hồ |
? |
|
Tảo nở hoa và thực vật phát triển |
? |
Lời giải:
|
Tên quá trình |
Thứ tự |
|
Thực vật chết. |
(6) |
|
Thiếu oxygen. |
(5) |
|
Thiếu ánh sáng mặt trời và oxygen nên tảo, thực vật và cá chết. |
(3) |
|
Vi khuẩn phát triển |
(4) |
|
Chất dinh dưỡng rửa trôi xuống ao, hồ |
(1) |
|
Tảo nở hoa và thực vật phát triển |
(2) |
Lời giải:
Giả sử, trong dung dịch HNO3 60% chứa 1 mol HNO3.
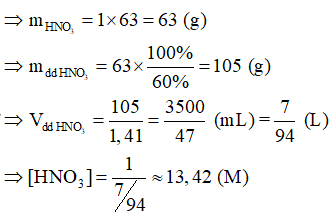
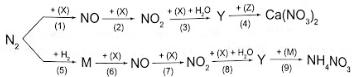
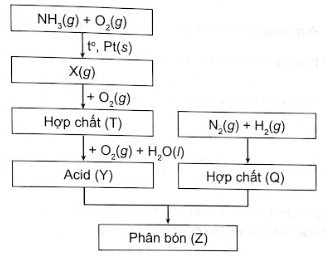
Hãy viết phương trình hoá học của các phản ứng trong sơ đồ chuyển hoá trên.
Lời giải:
Bài 5.12* trang 24 SBT Hóa học 11: N2O4(l) + 2N2H4(l) → 3N2(g) + 4H2O(g)
Biết enthalpy tạo thành chuẩn của các chất được trình bày trong bảng sau:
|
Chất |
N2O4(l) |
N2H4(l) |
H2O(g) |
|
(kJ/mol) |
-19,56 |
50,63 |
-241,82 |
a) Tính nhiệt đốt cháy 1 kg hỗn hợp lỏng gồm N2O4 và N2H4.
b) Tại sao hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa?
Lời giải:
Trong 1 kg hỗn hợp (tỉ lệ 1 mol N2O4 và 2mol N2H4), ta có:
Theo phương trình hóa học, nhiệt tỏa ra khi đốt cháy 1 mol N2O4 và 2 mol N2H4 là 1048,98 kJ.
=> Nhiệt tỏa ra khi đốt cháy 1 kg hỗn hợp lỏng gồm N2O4 và N2H4:
b) Quá trình đốt cháy hỗn hợp lỏng (N2O4 và N2H4) tỏa nhiệt mạnh và giải phóng một lượng lớn khí nên hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
Lý thuyết Một số hợp chất với oxygen của nitrogen
1. Các oxide của nitrogen – hiện tượng mưa acid
a) Nguồn gốc các oxide của nitrogen trong không khí
- Khí NO được tạo thành trong không khí ở nhiệt độ cao.
![]()
- Ở điều kiện thường, khí NO không màu kết hợp với oxygen trong không khí tạo khí NO2 màu nâu đỏ.
- Nitrogen oxide được hình thành từ những hiện tượng tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao. Các khí này độc, gây ảnh hưởng đến sức khỏe con người.
b) Hiện tượng mưa acid
- Mưa acid là hiện tượng nước mưa có pH nhỏ hơn 5,6 do lượng khí thải SO2 và NOx từ các quá trình tiêu thụ than đá, dầu mỏ hoặc các nguyên liệu tự nhiên khác trong sản xuất, sinh hoạt của con người.
- Các khí này hòa tan trong nước tạo thành dung dịch H2SO4 và dung dịch HNO3.
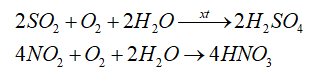
- Hiện tượng mưa acid gây ảnh hưởng đến đời sống con người, động – thực vật, môi trường, hủy hoại các công trình kiến trúc.
2. Nitric acid
a) Cấu tạo phân tử, tính chất vật lý
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO3 là liên kết cộng hóa trị và liên kết cho nhận.
- Số oxi hóa của N trong HNO3 là +5. Đây là số oxi hóa cao nhất của N, do đó trong các phản ứng oxi hóa – khử, HNO3 là chất oxi hóa.
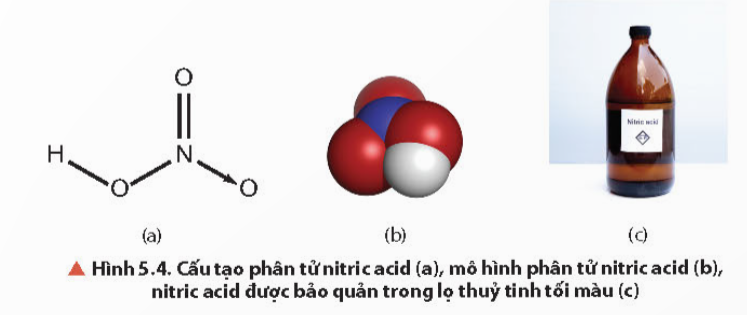
- Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng là 1,53 g/cm3, sôi ở 86˚C.
- Nitric acid tan trong nước theo bất kỳ tỉ lệ nào. Nitric acid thương mại thường có nồng độ 68%.
- Nitric acid tinh khiết kém bền, bị phân hủy ngay ở điều kiện thường khi có ánh sáng.
b) Tính chất hóa học và ứng dụng
- Nitric acid là một acid mạnh:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với basic oxide
+ Tác dụng với base
+ Tác dụng với muối của acid yếu hơn -> muối nitrate
- Nitric acid là một trong ba acid chính của ngành công nghiệp hóa chất hiện đại và có tính ăn mòn kim loại.
- Nitric acid là một acid có tính oxi hóa mạnh, oxi hóa được hầu hết các kim loại trừ vàng (Au), platium (Pt),…(một số kim loại như Al, Fe, Cr,… bị thụ động hóa trong dung dịch HNO3 đặc, nguội)
- Nitric acid có nhiều ứng dụng quan trọng trong đời sống và sản xuất: sản xuất thuốc nổ trinitrotoluene, sản xuất nitrobenzene, nước cường toan, sản xuất phân bón,…

3. Hiện tượng phú dưỡng
- Hiện tượng phú dưỡng xảy ra khi dư thừa nhiều chất dinh dưỡng trong môi trường nước như nitrate và phosphate.
- Hiện tượng này làm giảm chất lượng nước, làm ô nhiễm môi trường nước, gây ảnh hưởng tiêu cực đến đời sống con người cũng như các loài động vật sống dưới nước.