Với lời giải SBT Hóa học 11 trang 18 chi tiết trong Bài 5: Một số hợp chất quan trọng của nitrogen Cánh diều giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 5: Một số hợp chất quan trọng của nitrogen
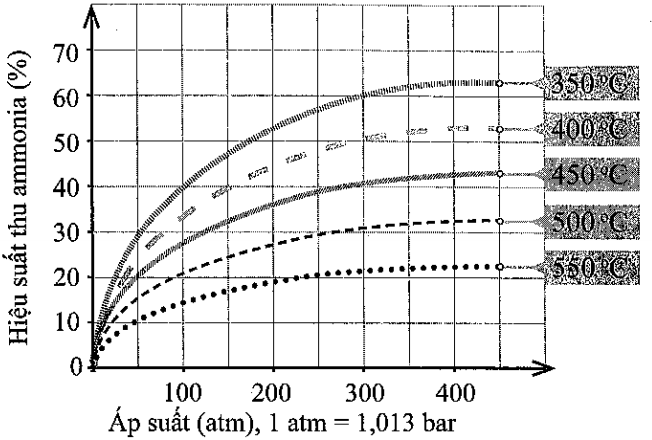
Hình 5. Sự phụ thuộc của hiệu suất tổng hợp ammonia vào áp suất và nhiệt độ phản ứng (Nguồn: Cowbridge Chemistry Department: Making ammonia − The Haber process http://ccschemistry.blogspot.com/2016/, truy cập ngày 22-3-2023.)
Hiệu suất thu ammonia có thể được tính theo công thức:

Khi phản ứng ưu tiên diễn ra theo chiều thuận thì lượng ammonia thu được trong thực tế càng nhiều.
a) Trong khoảng từ 350oC đến 550oC, hiệu suất thu ammonia biến đổi theo xu hướng nào?
b) Vì sao nhiệt độ phản ứng càng cao thì hiệu suất thu ammonia càng thấp?
c) Ở một nhiệt độ, vì sao áp suất tăng cao thì hiệu suất thu ammonia tăng?
d) Từ giản đồ Hình 5, hãy cho biết nên chọn nhiệt độ phản ứng là bao nhiêu để hiệu suất phản ứng đạt khoảng 44% ở 200 atm.
Lời giải:
Đáp án đúng là:
a) Giảm.
b) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, tức phản ứng nghịch. Điều đó làm giảm hiệu suất thu ammonia.
c) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi áp suất tăng thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức chiều giảm số mol khí, chiều thuận. Điều đó làm tăng hiệu suất thu ammonia.
d) Khoảng 400oC.
Lời giải:
- Quá trình sản xuất NH4Cl, NH4NO3, (NH4)2SO4 theo phản ứng trực tiếp giữa
ammonia và acid tương ứng; đó không phải là các phản ứng oxi hóa – khử.
- Quá trình sản xuất urea theo phản ứng:
2NH3 + CO2 (NH2)2CO + H2O
Đây không phải là phản ứng oxi hoá - khử.
- Các phản ứng trên không tạo khí độc. Tuy nhiên khi sử dụng dư thừa, phân bón chứa các chất này sẽ gây hiện tượng phú dưỡng cho nước và đất.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5.2 trang 17 SBT Hoá học 11: Phát biểu nào sau đây là không đúng khi nói về ammonia?...
Bài 5.9 trang 19 SBT Hoá học 11: Cho hai quá trình sau:...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác: