Với giải Bài 5.8 trang 19 SBT Hóa Học lớp 11 Cánh diều chi tiết trong Bài 5: Một số hợp chất quan trọng của nitrogen giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa Học 11 . Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 5.8 trang 19 SBT Hoá học 11: a)Viết cấu hình electron của nguyên tử nitrogen (7N) theo ô orbital. Nguyên tử N có bao nhiêu electron hoá trị ghép đôi, bao nhiêu electron hoá trị độc thân?
|
b) Có 2 đề xuất về công thức Lewis của phân tử HNO3 như bên: |
|
b1) Công thức (A) hay (B) phù hợp với đặc điểm các electron hoá trị của nguyên tử nitrogen? Theo công thức đó, hoá trị và số oxi hoá của N là bao nhiêu?
b2*) Kết quả nghiên cứu cho biết giá trị độ dài các liên kết giữa nguyên tử N và O (hên kết NO) trong phân tử HNO3 là 1,406 Å; 1,211 Å và 1,199 Å. Công thức (A) hay (B) có thể thoả mãn các số liệu đã cho? Giải thích.
Lời giải:
a) Cấu hình electron của nitrogen theo ô orbital:
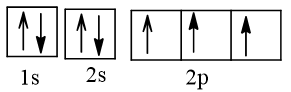
Có 1 cặp electron hoá trị ghép đôi, 3 electron hoá trị độc thân.
b) b1)Công thức (A) phù hợp hơn vì nguyên tử N chỉ có 4 orbital hoá trị, do đó chỉ có thể tạo tối đa 4 liên kết cộng hoá trị. Theo công thức (A), N có hoá trị là IV và số oxi hoá là +5.
b2*) Công thức (A) phù hợp với dữ liệu do có ba loại liên kết giữa N và O không tương đương nhau trong phân tử HNO3 (1 liên kết đôi, 1 liên kết đơn theo kiểu ghép đôi electron hoá trị và 1 liên kết đơn theo kiểu cho - nhận).
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5.2 trang 17 SBT Hoá học 11: Phát biểu nào sau đây là không đúng khi nói về ammonia?...
Bài 5.9 trang 19 SBT Hoá học 11: Cho hai quá trình sau:...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác: