Với giải sách bài tập Hóa học 11 Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Giải SBT Hóa học 11 trang 28
A. Vị trí X.
B. Vị trí Y.
C. Vị trí Z.
D. Vị trí T.
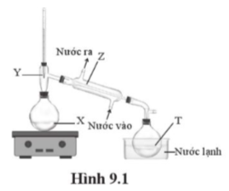
Lời giải:
Đáp án B.
A. Kết tinh.
B. Chưng cất.
C. Sắc kí.
D. Chiết.
Lời giải:
Đáp án B
A. Nhiệt độ sôi của chất.
B. Nhiệt độ nóng chảy của chất.
C. Tính tan của chất trong nước.
D. Màu sắc của chất.
Lời giải:
Đáp án A
A. Phân tử khối.
B. Nhiệt độ sôi.
C. Khả năng hấp phụ và hoà tan.
D. Nhiệt độ nóng chảy.
Lời giải:
Đáp án C
A. Tan trong dung môi phân cực, không tan trong dung môi không phân cực.
B. Tan tốt trong cả dung dịch nóng và lạnh.
C. Ít tan trong cả dung dịch nóng và lạnh.
D. Tan tốt trong dung dịch nóng, ít tan trong dung dịch lạnh.
Lời giải:
Đáp án D.
A. Chiết, chưng cất và kết tinh.
B. Chiết và kết tinh.
C. Chưng chất và kết tinh.
D. Chưng cất, kết tinh và sắc kí.
Lời giải:
Đáp án B.
A. pentan-1-ol, pent-1-ene và dipentyl ether.
B. pent-1-ene, pentan-1-ol và dipentyl ether.
C. dipentyl ether, pent-1-ene và pentan-1-ol.
D. pent-1-ene, dipentyl ether và pentan-1-ol.
Lời giải:
Xét theo nhiệt độ sôi pent-1-ene < pentan-1-ol < dipentyl ether. Đáp án B.
Lời giải:
Các hợp chất hoá học có sẵn trong tự nhiên hoặc tạo thành trong các phản ứng hoá học thường không ở dạng tinh khiết mà lẫn với chất khác. Cô lập và tinh chế nhằm có được chất mong muốn ở dạng tinh khiết.
Một số phương pháp dùng tinh chế chất hữu cơ: phương pháp kết tinh, phương pháp chiết, phương pháp chưng cất, phương pháp sắc kí,...
Ví dụ: Để có được đường saccharose, người ta lấy nước ép mía đem cô đặc rồi kết tinh để được tinh thể đường.Để có được rượu (dung dịch ethanol) từ hỗn hợp lên men của “cơm rượu”, người ta tiến hành chưng cất lấy rượu khỏi phần “bã rượu”.
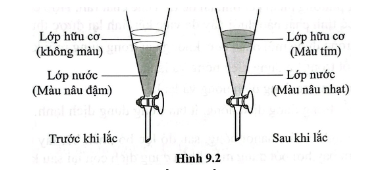
a) Phương pháp nào đã được sử dụng để thu lấy iodine từ dung dịch iodine trong nước trong quy trình được mô tả ở trên?
b) Hình 9.2 mô tả hiện tượng xảy ra trong dụng cụ dùng thu lấy iodine trong thí nghiệm trên. Cho biết tên của dụng cụ này.
c) Mô tả cách làm để tách riêng phần nước và phần hữu cơ từ dụng cụ ở Hình 9.2.
d) Giải thích sự khác nhau về màu sắc của lớp nước và lớp hữu cơ trong dụng cụ trên trước và sau khi lắc.
Lời giải:
a) Phương pháp sử dụng để thu lấy iodine từ dung dịch iodine trong nước là phương pháp chiết lỏng – lỏng.
b) Dụng cụ sử dụng là: phễu chiết.
c) Cách làm: Mở khoá phễu chiết, phần nước ở dưới sẽ thoát ra, lần lượt thu lấy phần nước và phần hữu cơ riêng biệt.
d) Do iodine tan tốt trong hexane hơn, nên ở lớp hữu cơ nồng độ iodine cao hơn và tạo thành dung dịch có màu tím.
a) Đưa các chú thích trên hình (đã cho trong khung) vào các vị trí (A, B, C, D, E, F) cho phù hợp.
b) Để yên nước lọc một thời gian nhưng chưa thấy chất rắn kết tinh như mong muốn. Yếu tố nào có thể là nguyên nhân của hiện tượng này?
c) Cần làm gì để có thể có được chất rắn kết tinh từ dung dịch thu được ở trường hợp b).
d) Cho biết tên của phương pháp đã sử dụng để tinh chế chất rắn ở trên.
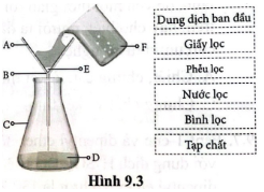
Lời giải:
a)
Dung dịch ban đầu: F;
Giấy lọc: A;
Phễu lọc: B;
Bình lọc: C;
Nước lọc: D;
Tạp chất: E.
b) Chất rắn chưa kết tinh có thể do dung dịch nước lọc chưa đạt đến nồng độ có thể kết tinh ở nhiệt độ thường.
c) Để thu được chất rắn kết tinh, ta cần làm lạnh dung dịch nước lọc và để yên để chất rắn kết tinh. Nếu không thấy kết tinh, cần cô đuổi một phần dung môi, sau đó để nguội cho kết tinh.
d) Phương pháp kết tinh lại.
a) Mô tả quá trình kết tinh lại mà học sinh trên đã thực hiện.
b) Giải thích vì sao sau khi kết tinh lại thì chất rắn ban đầu lại sạch hơn.
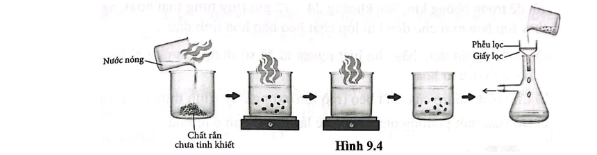
Lời giải:
a) Thêm dần nước nóng vào cốc chứa chất rắn chưa tinh khiết đến khi chất rắn tan hoàn toàn. Để nguội dung dịch để tạo thành tinh thể. Lọc lấy tinh thể chất rắn bằng phễu lọc có lót giấy lọc.
b) Sau khi kết tinh lại, một số chất bẩn tan vào dung dịch. Do nồng độ chất bẩn chưa đạt đến nồng độ quá bão hoà nên chất bẩn không kết tinh lại và bị lọc bỏ khỏi chất rắn kết tinh. Vì thế, chất rắn ban đầu trở nên sạch hơn.
a) Benzene thương mại lẫn tạp chất gì? Vì sao không tiến hành chưng cất ngay benzene thương mại để thu lấy benzene tinh khiết?
b) Vì sao sau khi xử lí benzene thương mại với dung dịch sulfuric acid đậm đặc thì loại bỏ được tạp chất?
c) Vì sao sau khi xử lí benzene thương mại với dung dịch sulfuric acid đậm đặc lại phải rửa benzene nhiều lần với nước?
d) Nước lẫn trong benzene được loại bỏ bằng cách nào? Dự đoán hiện tượng xảy ra và cho biết làm sao để biết nước đã không còn trong benzene sau khi được xử lí.
Lời giải:
a) Tạp chất có lẫn trong benzene thương mại là thiophene. Không chưng cất ngay benzene thương mại vì thiophene có nhiệt độ sôi không chênh lệch quá nhiều với benzene nên khi đun nóng cả 2 chất sẽ cùng bị bay hơi (ts = 84,2°C) và (ts = 80,1°C).
b) Do thiophene trong benzene thương mại phản ứng với dung dịch sulfuric acid đậm đặc, tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid còn benzene không tan trong dung dịch sulfuric acid đậm đặc nên loại bỏ được thiophene bằng phương pháp chiết.
c) Sau khi xử lí benzene thương mại với dung dịch sulfuric acid đậm đặc phải rửa benzene nhiều lần với nước để loại bỏ lượng nhỏ sulfuric acid còn lẫn trong benzene.
d) Nước lẫn trong benzene được loại bỏ bằng cách cho qua CuSO4 khan để trong hút nước. CuSO4 khan có màu trắng, khi hút nước tạo CuSO4.5H2O có màu xanh. Khi CuSO4 khan không còn chuyển sang màu xanh thì không còn nước trong benzene.
a) Cần dùng thể tích nước tối thiểu là bao nhiêu để chiết được lượng rutin có trong 100 gam hoa hoè?
b) Giả thiết rằng toàn bộ lượng rutin trong hoa hoè đã tan vào nước khi chiết. Làm nguội dung dịch chiết 100 gam hoa hoè ở trên từ 100°C xuống 25°C thì thu được bao nhiêu gam rutin kết tinh?
c) Vì sao khi sử dụng lượng nước lớn hơn thì khối lượng rutin thu được khi kết tinh lại giảm đi?
Lời giải:
a) Khối lượng rutin trong 100g hoa hòe là: 100.26% = 26 g
Thể tích nước cần dùng để hoà tan hết lượng rutin ở 100 °C là: 26 : 5,22 = 5 (lít)
b) 5 lít nước ở 25 °C chứa 5.0,125 = 0,625 (g) rutin.
Lượng rutin thu được khi để kết tinh là: 26 – 0,625 = 25,375 (g).
c) Do khi lượng nước tăng lên, lượng rutin được hòa tan ở 25oC sẽ tăn theo, lượng rutin kết tinh sẽ giảm đi.
a) Từ thông tin trên, hãy cho biết người ta đã sử dụng phương pháp nào để lấy tinh dầu từ hoa.
b) Cho biết vai trò của chất béo (mỡ lợn) trong quy trình thực hiện ở trên.
c) Đề xuất một phương pháp khác để lấy được tinh dầu hoa.
Lời giải:
a) Phương pháp đã sử dụng để thu lấy tinh dầu là phương pháp chiết
b) Mỡ lợn (chất béo) đóng vai trò dung môi chiết
c) Có thể sử dụng phương pháp chưng cất lôi cuốn hơi nước để thu lấy tinh dầu (cho hoa cắt nhỏ vào bình chưng cất, thêm nước rồi đun nóng và thu lấy hỗn hợp nước lẫn tinh dầu. Sau đó dùng phễu chiết, chiết riêng lấy phần tinh dầu không tan trong nước.
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 8: Hợp chất hữu cơ và hoá học hữu cơ
Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Bài 10: Công thức phân tử hợp chất hữu cơ
Bài 11: Cấu tạo hoá học của hợp chất hữu cơ
Lý thuyết Phương pháp tách biệt và tinh chế hợp chất hữu cơ
I. Phương pháp kết tinh
-Kết tinh là phương pháp quan trọng để tách biệt và tinh chế những chất hữu cơ ở dạng rắn.
-Nguyên tắc: chất rắn tách ra từ dung dịch bão hòa của chất đó khi thay đổi điều kiện hòa tan (dung môi, nhiệt độ).
II. Phương pháp chiết
-Dùng để chuyển chất từ hỗn hợp ở môi trường rắn hoặc lỏng sang môi trường lỏng khác để thu được chất có độ tinh khiết cao hơn.
-Nguyên tắc: mỗi chất lỏng có sự phân bố khác nhau trong hai môi trường không hòa tan vào nhau.
-Chiết chất từ môi trường rắn (chiết lỏng – rắn): Ngâm hoặc đun hỗn hợp chất rắn với dung môi thích hợp. Sau đó loại bỏ phần chất rắn không tan, thu lấy “dịch chiết” chứa chất cần phân tách.
-Chiết chất từ môi trường lỏng (chiết lỏng – lỏng).
III. Phương pháp chưng cất
-Là phương pháp tách và tinh chế quan trọng đối với các chất lỏng.
-Nguyên tắc: thành phần các chất khi bay hơi khác với thành phần của chúng có trong dung dịch lỏng.
-Chưng cất gồm hai giai đoạn: bay hơi và ngưng tụ.
IV. Phương pháp sắc kí
-Cơ sở của sắc kí: dựa trên sự khác nhau về khả năng được hấp thụ và hòa tan chất trong hỗn hợp cần tách.
+Chất hấp phụ (pha tĩnh): hấp phụ các chất trong hỗn hợp cần tách trên bề mặt của nó.
+Chất lỏng hoặc chất khí (pha động): đi qua pha tĩnh sẽ hòa tan và kéo chất tan đi theo.
-Có nhiều loại sắc kí: sắc kí giấy, sắc kí bản mỏng, sắc kí cột.