Với tóm tắt lý thuyết Hóa học lớp 11 Bài 3: Đơn chất nitrogen sách Chân trời sáng tạo hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 3: Đơn chất nitrogen
A. Lý thuyết Đơn chất nitrogen
1. Trạng thái tự nhiên
- Ở trạng thái tự nhiên, nitrogen tồn tại ở hai dạng:
+ Dạng đơn chất: Nitrogen chiếm khoảng 78% thể tích của không khí. Là hỗn hợp của hai đồng vị: 147N (99,63%) và 157N (0,37%)
+ Dạng hợp chất:
- Nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) - gọi là diêm tiêu natri.
- Nitrogen còn có trong thành phần của protein, nucleic acid,… và nhiều hợp chất hữu cơ khác
2. Tính chất vật lí
- Ở điều kiện thường:
+ Là chất khí không màu, không mùi, không vị, nhẹ hơn không khí
+ Hóa lỏng ở - 196 độ C, hóa rắn ở - 210 độ C
+ Ít tan trong nước
+ Không duy trì sự cháy và hô hấp.
3. Tính chất hóa học
- Ở điều kiện thường:
+ Phân tử Nitrogen rất bền, khá trơ
+ Nitrogen thể hiện tính oxi hóa, tính khử khi tác dụng với oxigen
Ví dụ:
N2 + 3H2 ⇌ 2NH3 (nhiệt độ, P, chất xúc tác)
N2 + O2 ⇌ 2NO (nhiệt độ)
4. Quá trình tạo và cung cấp Nitrogen cho đất từ nước mưa
- Nguyên tố Nitrogen rất cần thiết cho sự sống trên Trái Đất
- Nitrogen chuyển hóa từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín
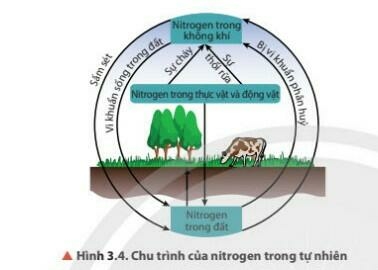
5. Ứng dụng
- Nitrogen là một trong những nguyên tố dinh dưỡng dính của thực vật
- Trong công nghiệp:
+ Nitrogen dùng để tổng hợp ammonia để sản xuất phân đạm, natric acid,…
+ Nitrogen sử dụng làm môi trường trơ cho các ngành công nghiệp: luyện kim, thực phẩm,...
+ Nitrogen lỏng dùng để bảo quản máu và mẫu sinh vật khác
Sơ đồ tư duy Đơn chất nitrogen
B. Trắc nghiệm Đơn chất nitrogen
Câu 1: Nitrogen thể hiện tính khử trong phản ứng nào sau đây?
A.
B.
C.
D.
Đáp án đúng là: A
Trong phản ứng này, số oxi hoá của N tăng từ 0 lên +2, do đó N2 đóng vai trò là chất khử.
Câu 2: Nhận định nào sau đây về đơn chất nitrogen là sai?
A. Không màu và nhẹ hơn không khí.
B. Hoá hợp với oxygen ở nhiệt độ cao hoặc tia lửa điện.
C. Thể hiện tính oxi hoá mạnh ở điều kiện thường.
D. Khó hoá lỏng và ít tan trong nước.
Đáp án đúng là: C
Nitrogen khá trơ ở điều kiện thường.
Câu 3: Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3.
B. 1.
C. 4.
D. 2.
Đáp án đúng là: A
Có 3 phản ứng oxi hoá – khử trong sơ đồ.
Câu 4: Nitrogen trong không khí có vai trò nào sau đây?
A. Cung cấp đạm tự nhiên cho cây trồng.
B. Hình thành sấm sét.
C. Tham gia quá trình quang hợp của cây.
D. Tham gia hình thành mây.
Đáp án đúng là: A
Nitrogen trong không khí có vai trò cung cấp đạm tự nhiên cho cây trồng.
Câu 5: Trong công nghiệp, phần lớn lượng nitrogen sản xuất ra được dùng để
A. tổng hợp phân đạm.
B. làm môi trường trơ trong luyện kim.
C. sản xuất nitric acid.
D. tổng hợp ammonia.
Đáp án đúng là: D
Trong công nghiệp, phần lớn lượng nitrogen sản xuất ra được dùng để tổng hợp ammonia từ đó sản xuất phân đạm, nitric acid.
Câu 6: Nguyên tố hóa học nào sau đây thuộc nhóm VA trong bảng tuần hoàn các nguyên tố hoá học?
A. Nitrogen.
B. Chlorine.
C. Carbon.
D. Oxygen.
Đáp án đúng là: A
Nitrogen thuộc nhóm VA trong bảng tuần hoàn các nguyên tố hoá học.
Câu 7: Công thức hoá học của diêm tiêu Chile (hay diêm tiêu natri) là
A. Ca(NO3)2.
B. NH4NO3.
C. NH4Cl.
D. NaNO3.
Đáp án đúng là: D
Sodium nitrate (NaNO3) còn được gọi với tên là diêm tiêu Chile.
Câu 8: Trong các phản ứng sau, phản ứng nào nitrogen đóng vai trò chất khử?
A.
B.
C.
D.
Đáp án đúng là: A
Trong phản ứng này, số oxi hoá của N tăng từ 0 lên +2, do đó N2 đóng vai trò là chất khử.
Câu 9: Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là
A. chất khử.
B. chất oxi hoá.
C. acid.
D. base.
Đáp án đúng là: B
Số oxi hoá của N giảm từ 0 xuống -3, do đó trong phản ứng này nitrogen đóng vai trò là chất oxi hoá.
Câu 10: Trong phản ứng hoá hợp với oxygen, nitrogen đóng vai trò là
A. chất oxi hoá.
B. base.
C. chất khử.
D. acid.
Đáp án đúng là: C
Trong phản ứng này, số oxi hoá của N tăng từ 0 lên +2, do đó N2 đóng vai trò là chất khử.
Câu 11: Hỗn hợp X gồm CO2 và N2 có Phần trăm khối lượng của nitrogen trong X là
A. 20%.
B. 80%.
C. 61,11%.
D. 38,89%.
Đáp án đúng là: D
Ta có:
Giả sử số mol CO2 là 1 mol Þ số mol N2 là 1 mol.
Câu 12: Cho phương trình nhiệt hóa học:
Lượng nhiệt tỏa ra khi dùng 9 g H2 (g) để tạo thành NH3 (g) là
A. 275,40 kJ.
B. 137,70 kJ.
C. 45,90 kJ.
D. 183,60 kJ.
Đáp án đúng là: B
Lượng nhiệt tỏa ra khi dùng 9 g H2 (g) để tạo thành NH3 (g) là:
Câu 13: Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO ở điều kiện chuẩn lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng: là bao nhiêu?
A. 225kJ.
B. 450kJ.
C. 220kJ.
D. 300kJ.
Đáp án đúng là: A
Câu 14: Cho a mol N2 phản ứng với 3a mol H2, sau phản ứng áp suất của hệ giảm 10%. Hiệu suất phản ứng tổng hợp NH3 là
A. 15%.
B. 25%.
C. 20%.
D. 30%.
Đáp án đúng là:
N2 + 3H2 ⇌ 2NH3
Ban đầu: a 3a 0 mol
Phản ứng: x 3x 2x mol
Cân bằng: (a – x) 3(a – x) 2x mol
Tổng số mol ban đầu: 4a mol
Tổng số mol các chất sau phản ứng: (4a – 2x) mol
Do đối với chất khí, tỉ lệ về thể tích cũng là tỉ lệ về số mol, nên:
Câu 15: Cho các phát biểu sau:
(a) Trong không khí, N2 chiếm khoảng 78% về thể tích.
(b) Phân tử N2 có chứa liên kết ba bền vững nên N2 trơ về mặt hóa học ngay cả khi đun nóng.
(c) Trong phản ứng giữa N2 và H2 thì N2 vừa là chất oxi hóa, vừa là chất khử.
(d) N2 lỏng có nhiệt độ thấp nên thường được sử dụng để bảo quản thực phẩm.
(e) Phần lớn N2 được sử dụng để tổng hợp NH3 từ đó sản xuất nitric acid, phân bón, ...
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án đúng là: A
(b) Sai vì N2 chỉ trơ về mặt hoá học ở nhiệt độ thường, khi đun nóng N2 trờ nên hoạt động hơn.
(c) Sai vì trong phản ứng giữa N2 và H2 thì N2 là chất oxi hoá, H2 là chất khử.
(d) Sai vì để bảo quản thực phẩm người ta sử dụng khí N2, N2 lỏng được sử dụng bảo quản máu và các mẫu sinh vật.
Xem thêm các bài tóm tắt Lý thuyết Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 3: Đơn chất nitrogen
Lý thuyết Bài 4: Ammonia và một số hợp chất ammonium