Với tóm tắt lý thuyết Hóa học lớp 11 Bài 1: Mở đầu về cân bằng hoá học sách Cánh diều hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 1: Mở đầu về cân bằng hoá học
A. Lý thuyết Mở đầu về cân bằng hoá học
I. Khái niệm phản ứng thuận nghịch và trạng thái cân bằng
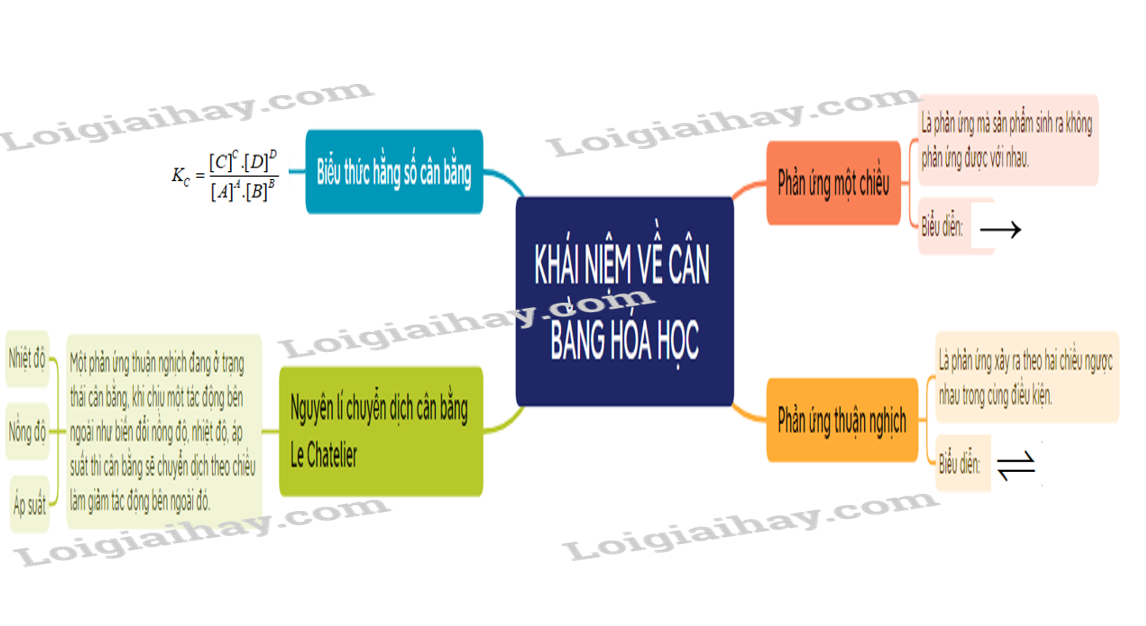
- Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sựu chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
II. Biểu thức hằng số cân bằng và ý nghĩa
1. Biểu thức hằng số cân bằng
- Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD.
Ở trạng thái cân bằng, hằng số cân bằng (KC) được xác định theo biểu thức:
Trong đó:
+ [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng.
+ a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
- Ví dụ: Xét phản ứng: C(s) + CO2(g) 2CO(g)
2. Ý nghĩa của biểu thức hằng số cân bằng
- Hằng số cân bằng KC phụ thuộc vào bản chất của phản ứng và nhiệt độ.
- KC càng lớn thì phản ứng thuận càng chiếm ưu thế và ngược lại.
III. Ảnh hưởng của nhiệt độ, nồng độ và áp suất đến cân bằng hóa học
1. Ảnh hưởng của nhiệt độ tới cân bằng hóa học
- Khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của tăng nhiệt độ và ngược lại.
2. Nguyên lí chuyển dịch cân bằng Le Chatelier
- Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
- Khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại.
- Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Sơ đồ tư duy Mở đầu về cân bằng hoá học
B. Trắc nghiệm Mở đầu về cân bằng hoá học
Câu 1: Cho phản ứng: 2SO2 (g) + O2 (g) 2SO3 (g), . Để thu được nhiều sản phẩm nhất thì ta phải:
A. giảm áp suất, giảm nhiệt độ.
B. giảm nhiệt độ và tăng áp suất.
C. tăng nhiệt độ, tăng áp suất.
D. tăng nhiệt độ và giảm áp suất.
Đáp án đúng là: B
Để thu được nhiều sản phẩm nhất thì ta phải tác động để cân bằng chuyển dịch theo chiều thuận. Như vậy:
- Tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí, tức chiều thuận.
- Có , chiều thuận toả nhiệt như vậy giảm nhiệt độ cân bằng sẽ chuyển dịch theo chiều thuận.
Câu 2: Cho hệ cân bằng trong một bình kín: N2 (g) + O2 2NO (g);
Cân bằng trên chuyển dịch theo chiều thuận khi nào?
A. Tăng nhiệt độ của hệ.
B. Giảm áp suất của hệ.
C. Thêm khí NO vào hệ.
D. Thêm chất xúc tác vào hệ.
Đáp án đúng là: A
chiều thuận thu nhiệt.
Tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, tức chiều thuận.
Câu 3: Xét phản ứng: 2NO(g) + O2(g) 2NO2(g). Phát biểu nào sau đây là đúng?
A. Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều thuận.
B. Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều nghịch.
C. Trong trường hợp này, áp suất không ảnh hưởng đến sự chuyển dịch cân bằng phản ứng.
D. Chất xúc tác sẽ làm cân bằng trên chuyển dịch theo chiều nghịch.
Đáp án đúng là: A
Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều làm giảm số mol khí, tức chiều thuận.
Câu 4: Trong các phản ứng sau đây, phản ứng nào áp suất không ảnh hưởng đến cân bằng phản ứng?
A. N2 + 3H2 2NH3.
B. N2 + O2 2NO.
C. 2NO + O2 2NO2.
D. 2SO2 + O2 2SO3.
Đáp án đúng là: B
Việc thay đổi áp suất không làm ảnh hưởng đến phản ứng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau.
Câu 5: Ở nhiệt độ không đổi, cân bằng nào sẽ dịch chuyển theo chiều thuận nếu tăng áp suất?
A. 2H2 (g) + O2 (g) 2H2O (g).
B. 2NO (g) N2 (g) + O2 (g).
C. 2SO3 (g) 2SO2 (g) + O2 (g).
D. 2CO2 (g) 2CO (g) + O2 (g).
Đáp án đúng là: A
Xét phản ứng: 2H2 (g) + O2 (g) 2H2O (g)
Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều làm giảm số mol khí, tức chiều thuận.
Câu 6: Nhận xét nào sau đây không đúng?
A. Trong phản ứng một chiều, sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Đáp án đúng là: C
Phát biểu C không đúng do phản ứng một chiều xảy ra hoàn toàn.
Câu 7: Cho phản ứng thuận nghịch: . Hằng số cân bằng của phản ứng trên là
A. .
B. .
C. .
D. .
Đáp án đúng là: D
Hằng số cân bằng của phản ứng trên là .
Câu 8: Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng: N2 + 3H2 2NH3. Sau một thời gian phản ứng đạt trạng thái cân bằng, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/L của N2 và H2 ban đầu lần lượt là
A. 3 và 6.
B. 2 và 3.
C. 4 và 8.
D. 2 và 4.
Đáp án đúng là: A
N2 + 3H2 2NH3
Ban đầu: x y 0 M
Phản ứng: 1 3 2 M
Còn lại: 2 3 2 M
Vậy x = 1 + 2 = 3 M; y = 3 + 3 = 6 M.
Câu 9: Cho phản ứng: N2 (g) + 3H2 (g) 2NH3 (g). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/L, N2 là 0,05 mol/L và của H2 là 0,10 mol/L thì hằng số cân bằng của phản ứng là bao nhiêu?
A. 18.
B. 60.
C. 3600.
D. 1800.
Đáp án đúng là: D
Câu 10: Cho phản ứng: H2 (g) + I2 (g) 2HI (g)
Ở nhiệt độ 430°C, hằng số cân bằng KC của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2 và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 430°C, nồng độ của HI gần nhất với
A. 0,275M.
B. 0,320M.
C. 0,151M.
D. 0,225M.
Đáp án đúng là: A
Ban đầu: 2 1,6 0 (mol)
Cân bằng: 2 − x 1,6 − x 2x (mol)
Ta có:
Suy ra, x = 1,375 (thoả mãn).
Vậy ở trạng thái cân bằng: [HI] = = 0,275 M.
Câu 11: Cho phản ứng thuận nghịch ở trạng thái cân bằng:
4NH3(g) + 3O2(g) ⇌ 2N2(g) + 6H2O(g); ∆rH < 0
Cân bằng sẽ chuyển dịch theo chiều thuận khi:
A. Tăng nhiệt độ.
B. Thêm chất xúc tác.
C. Tăng áp suất.
D. Loại bỏ hơi nước.
Đáp án đúng là: D
Loại bỏ hơi nước cân bằng sẽ chuyển dịch theo chiều tăng lượng nước, tức chiều thuận.
Câu 12: Xét cân bằng hóa học: CO2(g) + H2(g) CO(g) + H2O(g); ∆rH < 0
Yếu tố nào sau đây không làm chuyển dịch cân bằng?
A. Nhiệt độ.
B. Áp suất.
C. Nồng độ chất đầu.
D. Nồng độ sản phẩm.
Đáp án đúng là: B
Việc thay đổi áp suất không làm ảnh hưởng đến phản ứng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau.
Câu 13: Cho các phản ứng sau:
(1) H2(g) + I2(s) 2HI(g) ∆rH < 0;
(2) 2NO(g) + O2(g) 2NO2(g) ∆rH < 0;
(3) CO(g) + Cl2(g) COCl2(g) ∆rH < 0;
(4) CaCO3(s) CaO(s) + CO2(g) ∆rH < 0;
Khi tăng nhiệt độ và áp suất, số cân bằng đều chuyển dịch theo chiều thuận là
A. 3.
B. 2.
C. 1.
D. 0.
Đáp án đúng là: B
Tất cả các phản ứng đều có ∆rH < 0.
Xét yếu tố áp suất:
- Cân bằng (1) không chuyển dịch khi tăng áp suất do tổng số mol khí ở hai vế bằng nhau.
- Tăng áp suất, cân bằng (2) chuyển dịch theo chiều giảm số mol khí tức chiều thuận.
- Tăng áp suất, cân bằng (3) chuyển dịch theo chiều giảm số mol khí tức chiều thuận.
- Tăng áp suất, cân bằng (4) chuyển dịch theo chiều giảm số mol khí tức chiều nghịch.
Câu 14: Đối với một hệ ở trạng thái cân bằng, nếu thêm chất xúc tác thì:
A. Chỉ làm tăng tốc độ phản ứng thuận.
B. Chỉ làm tăng tốc độ phản ứng nghịch.
C. Làm tăng tốc độ phản ứng thuận và phản ứng nghịch như nhau.
D. Không làm tăng tốc độ phản thuận và phản ứng nghịch.
Đáp án đúng là: C
Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần như nhau.
Câu 15: Cho các phản ứng sau:
(1) Fe2O3 (s) + 3CO (g) 2Fe (s) + 3CO2 (g) ∆rH = -22,77 kJ;
(2) CaO (s) + CO2 (g) CaCO3 (s) ∆rH = -233,26 kJ;
(3) 2NO2(g) N2O4 (g) ∆rH = 57,84 kJ;
(4) H2(g) + I2 (g) 2HI (g) ∆rH = -10,44 kJ;
(5) 2SO2(g) + O2(g) 2SO3(g) ∆rH = -198,24 kJ.
Khi tăng nhiệt độ các phản ứng có cân bằng chuyển dịch theo chiều nghịch là
A. (1),(2),(3),(4),(5).
B. (1),(2),(3),(5).
C. (1),(2),(3),(4).
D. (1),(2),(4),(5).
Đáp án đúng là: D
Khi tăng nhiệt độ cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt.
Do đó sẽ lựa chọn các phản ứng có chiều thuận toả nhiệt, tức các phản ứng (1),(2),(4),(5).
Xem thêm các bài tóm tắt Hóa học lớp 11 Cánh Diều hay, chi tiết khác:
Lý thuyết Bài 1: Mở đầu về cân bằng hoá học
Lý thuyết Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base