Tailieumoi.vn xin giới thiệu đến các quý Thầy/Cô Giáo án điện tử Hóa học lớp 11 Cánh diều theo mẫu Giáo án POWERPOINT chuẩn của Bộ GD&ĐT. Hi vọng tài liệu này sẽ giúp Giáo viên dễ dàng biên soạn giáo án PPT Hóa học 11.
Chỉ từ 400k mua trọn bộ Giáo án Hóa học 11 Cánh diều bản POWERPOINT trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 30k cho 1 bài Giáo án lẻ bất kì):
B1: Gửi phí vào tài khoản0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Hóa 11 Bài 1: Mở đầu về cân bằng hoá học






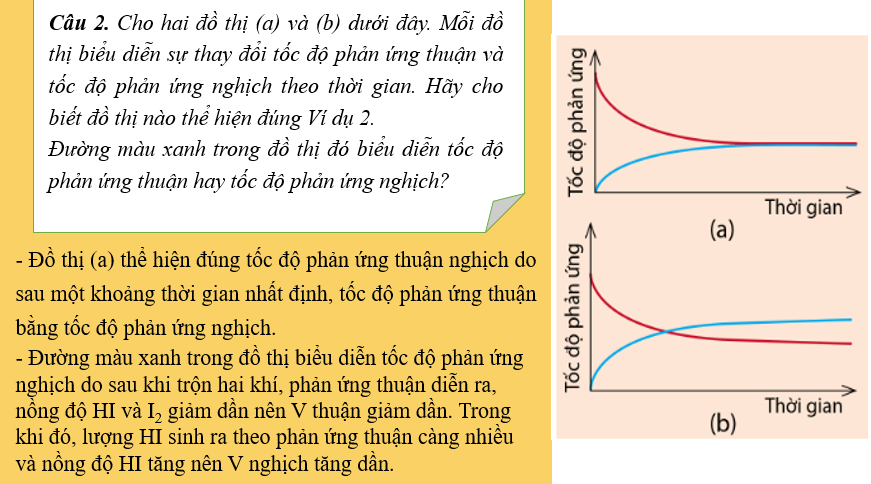



................................................
................................................
................................................
Tài liệu có 29 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT Hóa 11 Cánh diều Bài 1: Mở đầu về cân bằng hoá học.
Giáo án Bài 1: Mở đầu về cân bằng hoá học
I. Mục tiêu
1) Năng lực chung
- Năng lực tự chủ và tự học: Học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: Tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: Học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
- Năng lực giải quyết vấn đề và sáng tạo: Nhận thức được vấn đề, suy nghĩ tìm ra được cách giải quyết vấn đề và giải quyết được vấn đề.
2) Năng lực chuyên biệt
- Năng lực nhận thức hóa học: Trình bày được khái niệm phản ứng thuận nghịch và trạng thái cân bằng của một phản ứng thuận nghịch.
Viết được biểu thức hằng số cân bằng (Kc) của phản ứng thuận nghịch.
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Thực hiện được thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng.
- Năng lực vận dụng kiến thức, kỹ năng đã học: Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier (Lơ Sa – tơ – li – ê) để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học.
3) Phẩm chất
- Yêu nước: nhận biết được vẻ đẹp của tự nhiên, của đất nước thông qua bộ môn Hóa học.
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Hình ảnh: Sự biến đổi NO2 và N2O4.
- Video minh hoạ thí nghiệm 1; thí nghiệm 2 – SGK – có gắn mã QR.
- Phiếu học tập trên quizizz.
- Slide, máy tính, máy chiếu.
2. Học sinh
- Sách giáo khoa, sách bài tập, vở ghi.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung:
GV sử dụng câu hỏi phần mở đầu để dẵn dắt vào bài mới:
Khí NO2 (màu nâu đỏ) liên tục chuyển thành khí N2O4 (không màu) và ngược lại, tại một điều kiện xác định. Cũng tại điều kiện này, bình khí NO2 hay bình khí N2O4 (Hình 1.1), sau những khoảng thời gian xác định đều chuyển thành hỗn hợp khí có thành phần như nhau và không đổi theo thời gian.
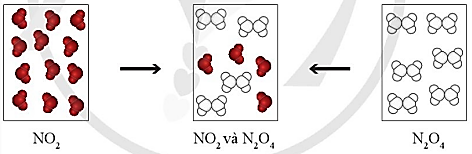
Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có phản ứng diễn ra trong hai bình này không?
- HS tiếp nhận vấn đề hình thành động cơ học tập.
c. Sản phẩm:
- Câu trả lời của HS. Dự đoán:
Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, phản ứng vẫn tiếp diễn trong hai bình.
Tuy nhiên, nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
GV chiếu hình ảnh: Sự biến đổi NO2 và N2O4.
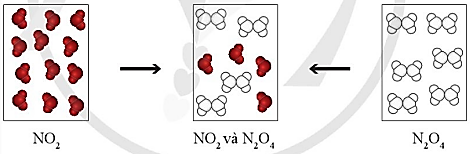
GV cung cấp thông tin: Khí NO2 (màu nâu đỏ) liên tục chuyển thành khí N2O4 (không màu) và ngược lại, tại một điều kiện xác định. Cũng tại điều kiện này, bình khí NO2 hay bình khí N2O4 (Hình 1.1), sau những khoảng thời gian xác định đều chuyển thành hỗn hợp khí có thành phần như nhau và không đổi theo thời gian.
GV đặt câu hỏi: Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có phản ứng diễn ra trong hai bình này không?
HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS suy nghĩ tìm câu trả lời.
- GV đôn đốc và hỗ trợ HS.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện HS trình bày câu trả lời.
- Câu trả lời của HS có thể đúng hoặc sai. GV không nhận xét tính đúng sai mà từ đó dẫn dắt HS vào bài mới.
GV dẫn dắt vào bài: Để kiểm chứng câu trả lời của bạn sau đây cô cùng các em tìm hiểu bài 1: Mở đầu về cân bằng hoá học.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu khái niệm phản ứng thuận nghịch
a) Mục tiêu: Nêu được khái niệm phản ứng thuận nghịch.
b) Nội dung:
- Học sinh thảo luận theo nhóm (cùng bàn), hoàn thiện phiếu học tập số 1, từ đó lĩnh hội kiến thức:
PHIẾU HỌC TẬP SỐ 1
1. Thế nào là phản ứng một chiều? phản ứng thuận nghịch?
2. Trong phản ứng thuận nghịch, chiều nào là chiều thuận? chiều nào là chiều nghịch?
3. Lấy ví dụ 2 phản ứng thuận nghịch mà em đã học.
4. Phản ứng thuận nghịch có xảy ra hoàn toàn được không? Vì sao?
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
1. Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều chất phản ứng biến đổi thành chất sản phẩm. Ví dụ: A → B.
Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
2. Chiều từ trái sang phải (chiều các chất ban đầu tạo thành sản phẩm) được gọi là chiều thuận.
Chiều từ phải sang trái (chiều các chất sản phẩm tạo thành chất ban đầu) là chiều nghịch.
3. Ví dụ hai phản ứng thuận nghịch đã học từ lớp 10:
H2 + I2 ⇌ 2HI
Cl2 + H2O ⇌ HCl + HClO
4. Phản ứng thuận nghịch xảy ra không hoàn toàn. Do phản ứng thuận nghịch xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng (ở cùng điều kiện).
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập GV yêu cầu học sinh thảo luận theo nhóm (cùng bàn) hoàn thiện phiếu học tập số 1. Học sinh nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập HS thảo luận theo bàn, hoàn thành phiếu học tập. GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 HS trình bày câu hỏi thảo luận (mỗi HS trình bày 2 câu). - Các HS còn lại theo dõi, góp ý nếu có. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức. |
I. Khái niệm phản ứng thuận nghịch Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. - Chiều từ trái sang phải (chiều các chất ban đầu tạo thành sản phẩm) được gọi là chiều thuận. - Chiều từ phải sang trái (chiều các chất sản phẩm tạo thành chất ban đầu) là chiều nghịch.
|
................................................
................................................
................................................
Xem thêm các bài giảng điện tử Hóa 11 Cánh diều hay, chi tiết khác:
Để mua Giáo án PPT Hóa học 11 Cánh diều năm 2024 mới nhất, mời Thầy/Cô liên hệ Mua tài liệu hay, chọn lọc