Lời giải bài tập Hóa học lớp 11 Bài 23: Hợp chất carbonyl sách Kết nối tri thức hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 23 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 23: Hợp chất carbonyl
Lời giải:
- Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có nhóm chức carbonyl (). Nhóm chức carbonyl có trong aldehyde, ketone …
- Hợp chất carbonyl có thể tham gia các phản ứng:
+ Phản ứng khử bởi các tác nhân khử như NaBH4; LiAlH4 …
+ Phản ứng cộng HCN vào liên kết đôi C = O.
+ Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm (phản ứng iodoform).
+ Aldehyde dễ bị oxi hoá bởi các tác nhân oxi hoá thông thường như: Br2/H2O; [Ag(NH3)2]OH, Cu(OH)2/OH−…
I. Khái niệm, danh pháp
Lời giải:
Các hợp chất carbonyl có công thức phân tử C4H8O:
- Hợp chất aldehyde:
CH3 – CH2 – CH2 – CHO: butanal;
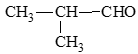
- Hợp chất ketone:
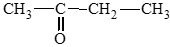
a) propanal;
b) 3 – methylbut – 2 – enal;
c) pentan – 2 – one;
d) 3 – methylbutan – 2 – one.
Lời giải:
a) propanal: CH3 – CH2 – CHO.
b) 3 – methylbut – 2 – enal:
c) pentan – 2 – one:
d) 3 – methylbutan – 2 – one.
III. Tính chất vật lí
|
CH3CH2CH2CH3 |
CH3CH2CHO |
CH3CH2CH2OH |
|
|
ts (oC) |
-0,5 |
49 |
97,1 |
So sánh nhiệt độ sôi của hợp chất carbonyl với ankane và alcohol có khối lượng phân tử tương đương. Dựa vào khả năng tạo liên kết hydrogen và sự phân cực của phân tử để giải thích.
Lời giải:
- Các hợp chất carbonyl có nhiệt độ sôi cao hơn các hydrocarbon có khối lượng phân tử tương đương. Do trong phân tử có chứa nhóm carbonyl phân cực làm cho phân tử hợp chất carbonyl phân cực.
- Các hợp chất carbonyl có nhiệt độ sôi thấp hơn các alcohol có khối lượng phân tử tương đương. Do các hợp chất carbonyl không tạo được liên kết hydrogen liên phân tử như alcohol.
IV. Tính chất hoá học
a) propanal;
b) 2 – methylbutanal;
c) butanone;
d) 3 – methylbutan – 2 – one.
Lời giải:
a) CH3 – CH2 – CHO CH3 – CH2 – CH2OH;
b) 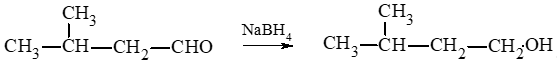
c) 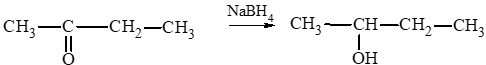
d) 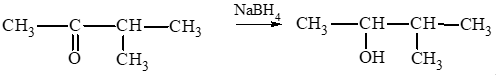
Hoạt động trang 140 Hóa học 11: Phản ứng của aldehyde với thuốc thử Tollens
Chuẩn bị: dung dịch CH3CHO 5%, dung dịch AgNO3 1%, dung dịch NH3 5%, cốc nước nóng, ống nghiệm.
Tiến hành:
- Cho khoảng 1 mL dung dịch AgNO3 1% vào ống nghiệm.
- Thêm từ từ dung dịch NH3 5% vào ống nghiệm và lắc đều đến khi kết tủa tan hoàn toàn.
- Nhỏ vài giọt dung dịch CH3CHO 5% vào ống nghiệm, lắc đều.
- Đặt ống nghiệm vào cốc chứa nước nóng (khoảng 70 – 80 oC), để yên khoảng 5 phút.
Giải thích hiện tượng quan sát được và viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Hiện tượng: Có lớp bạc sáng bóng bám vào thành ống nghiệm. Do aldehyde đã khử Ag+ trong thuốc thử Tollens về Ag.
Phương trình hoá học:
CH3CHO + 2[Ag(NH3)2]OH CH3COONH4 + 2Ag + 3NH3 + H2O.
Hoạt động trang 141 Hóa học 11: Nghiên cứu phản ứng oxi hoá aldehyde bằng copper(II) hydroxide
Thí nghiệm oxi hoá CH3CHO bằng Cu(OH)2 được tiến hành như sau:
- Cho khoảng 0,5 mL dung dịch CuSO4 5% và khoảng 1 mL dung dịch NaOH 10% vào ống nghiệm, lắc đều hỗn hợp.
- Thêm khoảng 1 mL CH3CHO 5% vào ống nghiệm, lắc đều ống nghiệm.
- Đun nóng nhẹ ống nghiệm trên ngọn lửa đèn cồn. Hỗn hợp phản ứng chuyển dần từ màu xanh lam sang màu đỏ gạch.
Trả lời câu hỏi và thực hiện yêu cầu sau:
1. Khi cho dung dịch CuSO4 vào dung dịch NaOH, hỗn hợp tạo kết tủa màu xanh lam, kết tủa đó là chất gì?
2. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm trên.
Lời giải:
1. Khi cho dung dịch CuSO4 vào dung dịch NaOH, hỗn hợp tạo kết tủa màu xanh lam, kết tủa đó là copper(II) hydroxide (Cu(OH)2).
2. Phương trình hoá học của các phản ứng xảy ra:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O + 3H2O.
a) Thuốc thử Tollens;
b) Cu(OH)2/ NaOH.
Lời giải:
a) HCHO + 2[Ag(NH3)2]OH HCOONH4 + 2Ag + 3NH3 + H2O;
Do HCOONH4 vẫn còn nhóm carbonyl trong phân tử nên tiếp tục có phản ứng:
HCOONH4 + 2[Ag(NH3)2]OH (NH4)2CO3 + 2Ag + 3NH3 + H2O.
b) HCHO + 2Cu(OH)2 + NaOH HCOONa + Cu2O + 3H2O;
HCOONa vẫn còn nhóm carbonyl trong phân tử nên tiếp tục có phản ứng:
HCOONa + 2Cu(OH)2 + NaOH Na2CO3 + Cu2O + 3H2O.
Hoạt động trang 142 Hóa học 11: Nghiên cứu phản ứng tạo iodoform từ acetone
Phản ứng tạo iodoform từ acetone được tiến hành như sau:
- Cho khoảng 2 mL dung dịch I2 bão hoà trong KI vào ống nghiệm.
- Thêm khoảng 2 mL dung dịch NaOH 2 M.
- Thêm tiếp khoảng 0,5 mL acetone vào hỗn hợp trên và lắc đều ống nghiệm, quan sát thấy xuất hiện kết tủa màu vàng.
Viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Phương trình hoá học:
CH3 – CO – CH3 + 3I2 + 4NaOH → CH3COONa + 3NaI + CHI3 + 3H2O.
Câu hỏi 5 trang 142 Hóa học 11: Hoàn thành các phản ứng sau:
a) HCHO + HCN →
b) CH3COCH(CH3)2 + I2 + NaOH →
Lời giải:
a) HCHO + HCN →
b) CH3COCH(CH3)2 + 3I2 + 4NaOH → CHI3 + (CH3)2CH – COONa + 3NaI + 3H2O.
Câu hỏi 6 trang 142 Hóa học 11: Trong các hợp chất sau, hợp chất nào tham gia phản ứng iodoform?
a) methanal;
b) ethanal;
c) butanone;
d) pentan – 3 – one.
Lời giải:
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm (phản ứng iodoform).
Vậy các hợp chất tham gia phản ứng iodoform là:
b) ethanal: CH3 – CHO.
c) butanone:
V. Ứng dụng
Hoạt động trang 143 Hóa học 11: Em hãy tìm hiểu và trình bày ứng dụng của một số aldehyde.
Lời giải:
Ứng dụng của một số aldehyde:
+ Formaldehyde được dùng chủ yếu để sản xuất nhựa như poly(phenol – formaldehyde) và urea formaldehyde. Formaldehyde cũng được sử dụng để sản xuất phẩm nhuộm, chất nổ và dược phẩm. Dung dịch 37% - 40% formaldehyde trong nước, được gọi là formalin, được dùng để ngâm xác động thực vật, tẩy uế, tiệt trùng.
+ Acetaldehyde (ethanal) được dùng nhiều trong tổng hợp hữu cơ để điều chế nhiều dược phẩm hoặc các chất có ứng dụng trong thực tiễn. Ví dụ từ acetaldehyde, người ta điều chế được ethylidene diacetate dùng để sản xuất poly(vinyl acetate).
+ Acetone có thể hoà tan tốt nhiều chất hữu cơ khác nhau (kể cả các polymer như cellulose trinitrate). Vì vậy một lượng lớn acetone được dùng làm dung môi trong sản xuất tơ nhân tạo, thuốc súng không khói … Ngoài ra, acetone còn được dùng nhiều trong tổng hợp hữu cơ như để tổng hợp bisphenol – A, chloroform, thuốc an thần solfonal, …
+ Nhiều hợp chất carbonyl có mùi thơm riêng biệt và được sử dụng làm chất tạo hương trong công nghiệp thực phẩm và mĩ phẩm: Benzaldehyde là chất cho mùi và hương vị của quả hạnh nhân, cinnamaldehyde cho mùi thơm của tinh dầu quế, vanillin là chất tạo hương chính cho mùi thơm của kem vani, methone có mùi thơm của bạc hà, citral cho mùi thơm nhẹ của tinh dầu xả.
VI. Điều chế
- Tìm hiểu về ứng dụng của các hợp chất aldehyde, ketone có trong tự nhiên và vai trò của một số aldehyde, ketone quan trọng trong cơ thể con người.
Lời giải:
- Phản ứng của aldehyde với thuốc thử Tollens tạo thành lớp bạc mỏng, sáng bóng bám vào thành bình phản ứng nên phản ứng này được ứng dụng trong quá trình sản xuất gương.
- Một số hợp chất carbonyl có thể hoà tan tốt nhiều chất hữu cơ khác nhau (kể cả các polymer) nên được ứng dụng để làm dung môi.
- Trong tự nhiên, các hợp chất chứa nhóm chức aldehyde và ketone tồn tại khá phổ biến trong tinh dầu của nhiều loài cây cỏ được sử dụng làm chất tạo hương trong công nghiệp thực phẩm và mĩ phẩm.
- Trong cơ thể người, một lượng nhỏ acetone được tạo ra qua quá trình chuyển hoá chất béo không hoàn toàn. Ở người khoẻ mạnh, acetone được hình thành ở gan và được chuyển hoá gần như hoàn toàn, chỉ có một lượng rất nhỏ xuất hiện ở nước tiểu. Sự hiện diện bất thường của acetone trong nước tiểu là một dấu hiệu của bệnh tiểu đường và được phát hiện qua việc xét nghiệm nớc tiểu (chỉ số KET).
Lý thuyết Hợp chất carbonyl
1. Khái niệm, danh pháp
a. Khái niệm
Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có chứa nhóm chức carbonyl. Nhóm chức carbonyl có trong aldehyde, ketone,...
b. Danh pháp
* Danh pháp thay thế:
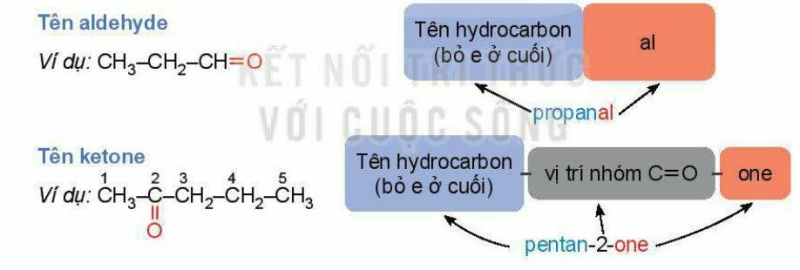
* Tên gọi thông thường:
Một số aldehyde, ketone đơn giản được gọi theo tên thông thường có nguồn gốc lịch sử. Tên thông thường của các aldehyde có nguồn gốc từ tên của acid tương ứng.
2. Đặc điểm cấu tạo
Liên kết đôi C=O phân cực về phía nguyên tử oxygen:
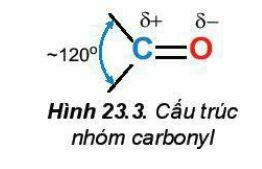
3. Tính chất vật lí
- Các aldehyde, ketone có nhiệt độ sôi cao hơn các hydrocarbon có khối lượng phân tử tương đương.
- Ở nhiệt độ thường, các aldehyde ở thể khí và có phân tử khối nhỏ, tan tốt trong nước. Khi số nguyên tử carbon tăng thì độ tan của hợp chất carbonyl giảm dần.
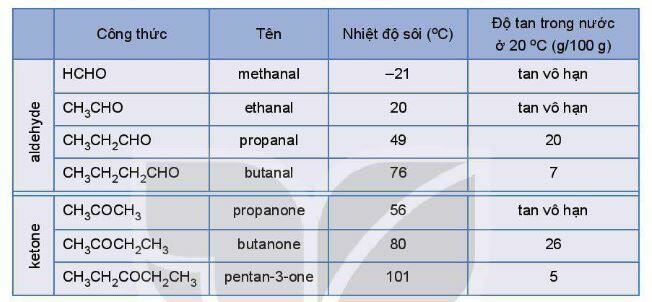
4. Tính chất hoá học
a. Phản ứng khử
Các hợp chất carbonyl bị khử bởi các tác nhân khử như NaBH4, LiAlH4,... (kí hiệu [H]) tạo thành các alcohol tương ứng, aldehyde bị khử tạo thành alcohol bậc I, ketone bị khử tạo thành alcohol bậc II.
b. Phản ứng oxi hóa aldehyde
* Oxi hóa aldehyde bởi nước:
Aldehyde bị oxi hoá bởi nước bromine tạo thành carboxylic acid.
Ví dụ: CH3CHO + Br2 + H2O → CH3COOH + 2HBr
* Oxi hoá aldehyde bởi thuốc thử Tollens
Thuốc thử Tollens là phức chất của ion Ag+ với ammonia, có công thức [Ag(NH3)2]OH. Ion Ag+ trong thuốc thử Tollens đóng vai trò là chất oxi hoá.
* Oxi hoá aldehyde bång copper(II) hydroxide
Aldehyde có thể bị oxi hoá bởi copper(II) hydroxide Cu(OH)2 trong môi trường kiềm khi đun nóng tạo thành kết tủa copper(I) oxide (Cu2O) màu đỏ gạch:
RCHO + 2 Cu(OH)2 + NaOH → RCOONa + Cu2O + 3H20
c. Phản ứng cộng
Hợp chất carbonyl có thể tham gia phản ứng cộng với HCN vào liên kết đối C=O.
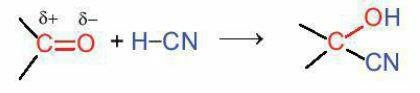
d. Phản ứng tạo iodoform
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2, trong môi trường kiềm.

Phản ứng tạo sản phẩm kết tủa indoform nên phản ứng này được gọi là phản ứng lodoform và được dùng để nhận biết các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl.
5. Ứng dụng
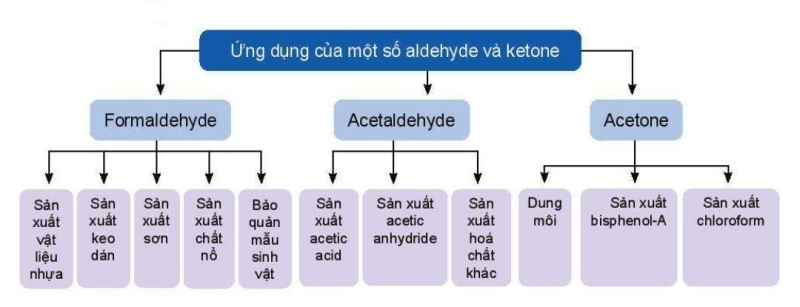
6. Điều chế
Một số hợp chất carbonyl được tổng hợp trong công nghiệp bằng phương pháp oxi hoá các hydrocarbon, oxi hóa ethylene thành acetaldehyde, oxi hoá cumene thành acetone.
Sơ đồ tư duy Hợp chất carbonyl
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác: