Lời giải bài tập Hóa học lớp 11 Bài 21: Phenol sách Kết nối tri thức hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 21 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 21: Phenol
Lời giải:
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm – OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Phenol có các tính chất hoá học đặc trưng:
+ Tham gia phản ứng thế nguyên tử H của nhóm – OH (tính acid).
+ Tham gia phản ứng thế ở vòng thơm.
IV. Tính chất hoá học
Thí nghiệm phenol tác dụng với dung dịch NaOH và với dung dịch Na2CO3 được tiến hành như sau:
- Cho vào hai ống nghiệm, mỗi ống nghiệm khoảng 1 mL dung dịch phenol bão hoà (có màu trắng đục).
- Cho khoảng 1 mL dung dịch NaOH 2 M vào ống nghiệm (1) và lắc đều.
- Cho khoảng 1 mL dung dịch Na2CO3 2 M vào ống nghiệm (2) và lắc đều.
Cả hai ống nghiệm đều quan sát được dung dịch từ màu trắng đục chuyển sang trong suốt.
Hãy giải thích các hiện tượng xảy ra.
Lời giải:
Hiện tượng: Ở cả hai ống nghiệm dung dịch từ màu trắng đục chuyển sang trong suốt.
Giải thích:
- Phenol ít tan trong nước ở điều kiện thường do đó ban đầu dung dịch có màu trắng đục;
- Phenol phản ứng với các dung dịch NaOH, Na2CO3 tạo thành các muối tan nên sau phản ứng thu được dung dịch trong suốt.
Phương trình hoá học:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3.
Lời giải:
Trong dung dịch nước, phenol phân li theo cân bằng sau:
C6H5OH + H2O ⇌ C6H5O− + H3O+
Do đó, phenol là một acid yếu, có thể tác dụng được với dung dịch NaOH.
Alcohol là chất không điện li, nên không có khả năng phân li như phenol nên không tác dụng với NaOH.
Hoạt động trang 131 Hóa học 11: Phản ứng của phenol với nước bromine
Phản ứng của phenol với nước bromine được tiến hành như sau:
- Cho khoảng 1,0 mL dung dịch phenol 5% vào ống nghiệm.
- Nhỏ vài giọt nước bromine bão hoà vào ống nghiệm, lắc đều. Nước bromine mất màu và xuất hiện kết tủa trắng.
Hãy giải thích hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Lời giải:
Hiện tượng: Nước bromine mất màu và xuất hiện kết tủa trắng do phenol phản ứng với nước bromine tạo thành sản phẩm thế 2,4,6 – tribromophenol ở dạng kết tủa màu trắng.
Phương trình hoá học:
Lời giải:
Benzene phản ứng với Br2 trong điều kiện đun nóng và có xúc tác FeBr3. Phenol phản ứng với Br2 ngay điều kiện thường và không cần chất xúc tác. Điều đó chứng tỏ do ảnh hưởng của nhóm – OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.
Lời giải:
Hoạt động trang 132 Hóa học 11: Nghiên cứu phản ứng nitro hoá phenol – tổng hợp picric acid
Thí nghiệm nitro hoá phenol được tiến hành như sau:
- Cho 0,5 g phenol và khoảng 1,5 mL H2SO4 đặc vào ống nghiệm, đun nhẹ hỗn hợp trong khoảng 10 phút để thu được chất lỏng đồng nhất.
- Để nguội ống nghiệm rồi ngâm bình trong cốc nước đá.
- Nhỏ từ từ 3 mL dung dịch HNO3 đặc vào hỗn hợp và lắc đều. Nút bằng bông tẩm dung dịch NaOH.
- Đun cách thuỷ hỗn hợp trong nồi nước nóng 15 phút.
- Làm lạnh hỗn hợp rồi đem pha loãng hỗn hợp với khoảng 10 mL nước cất, picric acid kết tủa ở dạng tinh thể màu vàng.
Hãy giải thích hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Chú ý: Thí nghiệm thực hiện trong tủ hốt hoặc nơi thoáng khí. Cần thận trọng khi làm việc với dung dịch HNO3 đặc và dung dịch H2SO4 đặc.
Lời giải:
Phenol phản ứng với dung dịch nitric acid đặc trong dung dịch sulfuric acid đặc tạo ra sản phẩm 2,4,6 – trinitrophenol (picric acid, dạng tinh thể màu vàng).
Phương trình hoá học:
VI. Điều chế
Lời giải:
Phenol được sử dụng nhiều trong công nghiệp hoá chất và y học.
Phenol là nguyên liệu chính để sản xuất bisphenol A, một chất trung gian dùng trong sản xuất nhựa epoxy. Phenol cũng được sử dụng nhiều trong sản xuất nhựa phenol – formaldehyde hay poly(phenol – formaldehyde).
Phenol được dùng để sản xuất phẩm nhuộm, sản xuất thuốc nổ (2,4,6 – trinitrophenol), chất diệt cỏ 2,4 – D (2,4 – dichlorophenoxyacetic acid); chất diệt nấm mốc (các đồng phân của nitrophenol),…
Do có tính diệt khuẩn nên phenol được dùng làm chất khử trùng, tẩy uế. Thuốc xịt chloraseptic chứa 1,4% phenol được dùng làm thuốc chữa đau họng.
Lời giải:
Một số sản phẩm có phenol trong thành phần:
Lý thuyết Phenol
1. Khái niệm
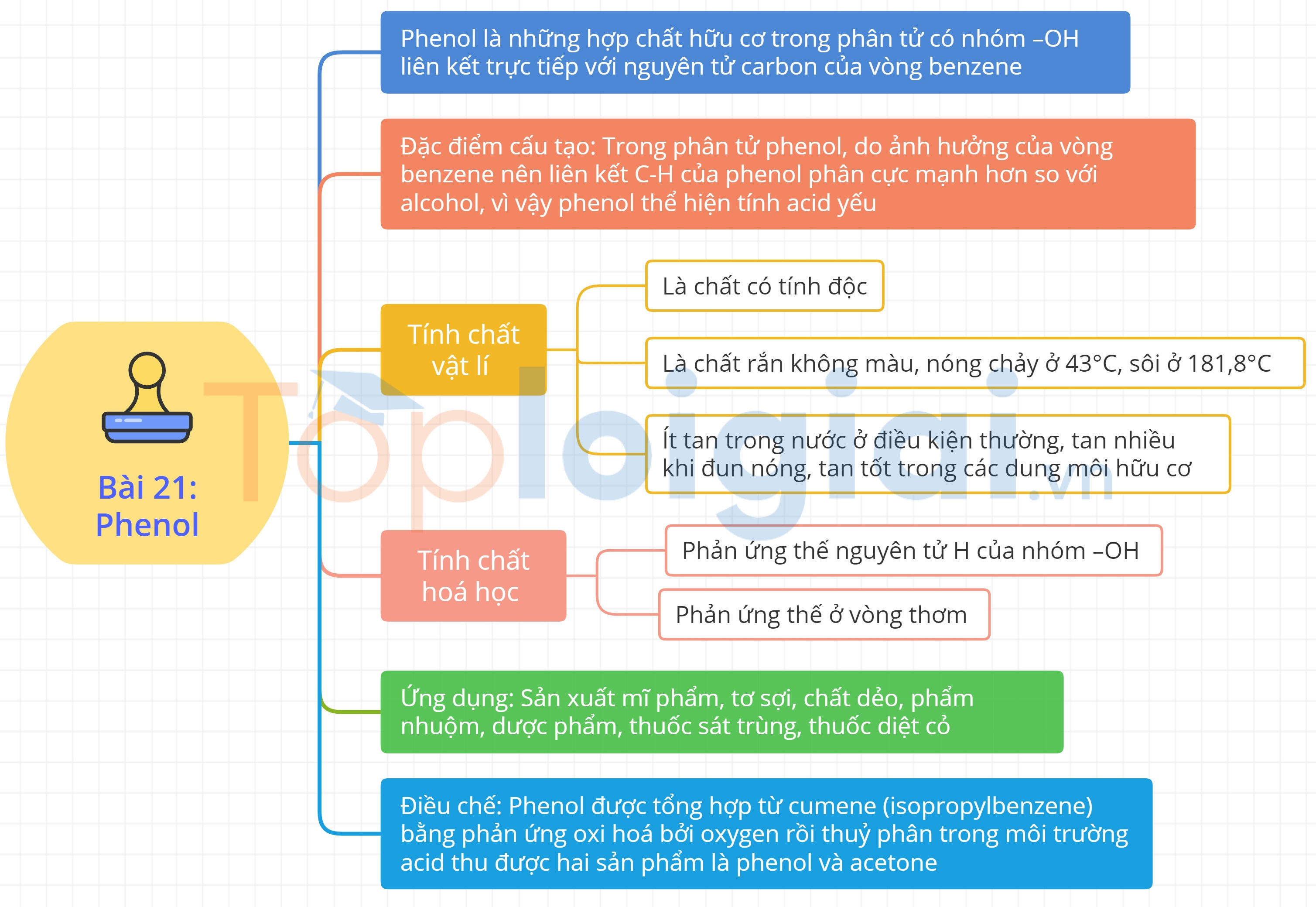
Phenol là những hợp chất hữu cơ trong phân tử có nhóm –OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
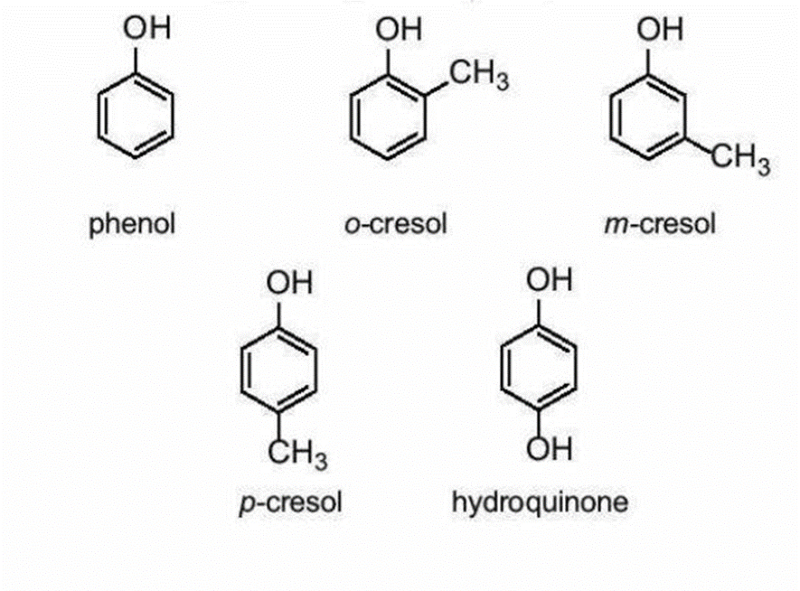
Hợp chất phenol đơn giản nhất có công thức là C6H5OH cũng có tên gọi riêng là phenol. Tên thông thường của một số phenol:
2. Đặc điểm cấu tạo của phenol
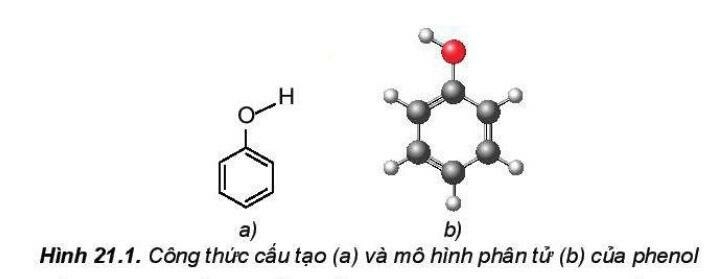
Trong phân tử phenol, do ảnh hưởng của vòng benzene nên liên kết C-H của phenol phân cực mạnh hơn so với alcohol, vì vậy phenol thể hiện tính acid yếu.
3. Tính chất vật lí
- Là chất có tính độc.
- Ở điều kiện thường, phenol là chất rắn không màu, nóng chảy ở 43°C, sôi ở 181,8oC.
- Ít tan trong nước ở điều kiện thường (độ tan trong nước ở 25°C: 8,42 g/100g nước), tan nhiều khi đun nóng (tan vô hạn ở 66°C); tan tốt trong các dung môi hữu cơ như ethanol, ether và acetone.
4. Tính chất hoá học
a. Phản ứng thế nguyên tử H của nhóm –OH (tính acid của phenol)
Trong dung dịch nước, phenol phân li theo cân bằng sau:
C6H5OH + H2O ⇌ C6H5O- + H3O+
Phenol là một acid yếu, dung dịch phenol không làm đổi màu quỳ tím và có thể phản ứng được với các kim loại kiềm, dung dịch base,…
b. Phản ứng thế ở vòng thơm
* Phản ứng bromine hóa:
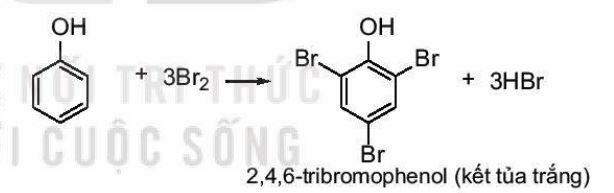
Phenol phản ứng với nước bromine tạo sản phẩm thể 2,4,6-tribromophenol ở dạng kết tủa màu trắng. Do ảnh hưởng của nhóm –OH, phản ứng thể nguyên tử hydrogen ở vòng benzene của Br 2,4,6-tribromophenol (kết tủa trắng) phend xảy ra dễ dùng hơn so với benzene.
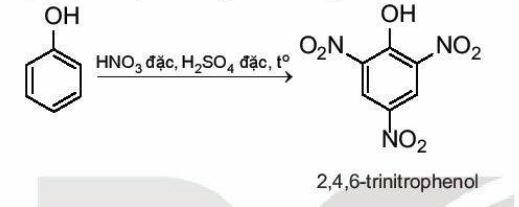
* Phản ứng nitro hóa:
Phenol phản ứng với dung dịch nitric acid đặc trong dung dịch sulfuric acid đặc tạo thành sản phẩm 2,4,6-trinitrophend (picric acid).
5. Ứng dụng
- Sản xuất mĩ phẩm.
- Sản xuất tơ sợi.
- Sản xuất chất dẻo.
- Sản xuất phẩm nhuộm.
- Sản xuất dược phẩm.
- Sản xuất thuốc sát trùng.
- Sản xuất thuốc diệt cỏ.
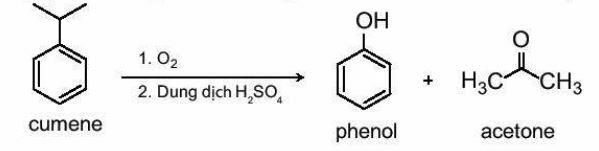
6. Điều chế
Phenol được tổng hợp từ cumene (isopropylbenzene) bằng phản ứng oxi hoá bởi oxygen rồi thuỷ phân trong môi trường acid thu được hai sản phẩm là phenol và acetone:
Sơ đồ tư duy Phenol
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác: