Với giải Vận dụng 1 trang 22 Hóa học lớp 11 Cánh diều chi tiết trong Bài 3: pH của dung dịch. Chuẩn độ acid – base giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Vận dụng 1 trang 22 Hoá học 11: Vì sao có thể dùng thuốc muối NaHCO3 khi điều trị bệnh thừa acid trong dạ dày?
Lời giải:
Dịch vị dạ dày của con người có chứa acid HCl với pH dao động khoảng 1,5 đến 3,5. Khi nồng độ acid trong dạ dày tăng cao con người sẽ bị đau dạ dày. Thuốc muối chứa NaHCO3 sẽ phản ứng với HCl giúp làm giảm nồng độ HCl trong dạ dày, làm giảm cơn đau dạ dày.
NaHCO3 + HCl → NaCl + CO2 + H2O.
Lý thuyết pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
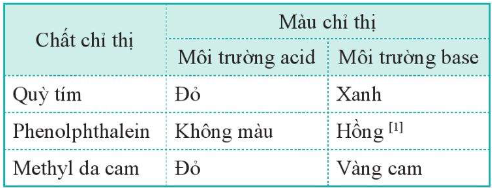
3. Xác định pH bằng chất chỉ thị
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 21 Hoá học 11: Giải thích vì sao nước nguyên chất có môi trường trung tính.....
Luyện tập 1 trang 21 Hoá học 11: Sử dụng máy tính cầm tay để tính:....
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác: