Với giải Luyện tập 1 trang 21 Hóa học lớp 11 Cánh diều chi tiết trong Bài 3: pH của dung dịch. Chuẩn độ acid – base giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Luyện tập 1 trang 21 Hoá học 11: Sử dụng máy tính cầm tay để tính:
a) pH của các dung dịch có nồng độ H+ lần lượt là: 0,01 M; 0,5 M và 1 M.
b) Nồng độ H+ của các dung dịch có pH lần lượt là 2,0; 7,4 và 14.
Lời giải:
a) Áp dụng công thức pH = -log[H+] ta có pH của các dung dịch được thể hiện trong bảng sau:
|
Nồng độ (M)
|
0,01
|
0,5
|
1
|
|
pH
|
2
|
0,3
|
0
|
b) Áp dụng công thức [H+] = 10-pH ta có nồng độ H+ của các dung dịch được thể hiện trong bảng sau:
|
pH
|
2
|
7,4
|
14
|
|
Nồng độ (M)
|
0,01
|
3,98.10-8
|
10-14
|
Lý thuyết pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
3. Xác định pH bằng chất chỉ thị
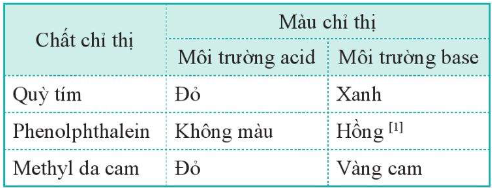
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Mở đầu trang 20 Hoá học 11: Các acid như acetic acid trong giấm ăn, citric acid trong quả chanh, oxalic acid trong quả khế đều tan và phân li trong nước. Chẳng hạn, acetic acid (CH3COOH) phân li theo phương trình sau:....
Câu hỏi 1 trang 21 Hoá học 11: Giải thích vì sao nước nguyên chất có môi trường trung tính.....
Câu hỏi 2 trang 21 Hoá học 11: Giải thích vì sao khi thêm HCl vào nước nguyên chất thì dung dịch thu được có [H+] > 10-7 M....
Luyện tập 1 trang 21 Hoá học 11: Sử dụng máy tính cầm tay để tính:....
Luyện tập 2 trang 22 Hoá học 11: Giải thích vì sao việc thiếu acid trong dạ dày là một nguyên nhân gây nên bệnh nhiễm khuẩn đường tiêu hoá.....
Vận dụng 1 trang 22 Hoá học 11: Vì sao có thể dùng thuốc muối NaHCO3 khi điều trị bệnh thừa acid trong dạ dày?...
Luyện tập 3 trang 22 Hoá học 11: Đất nhiễm phèn có pH trong khoảng 4,5 – 5,0. Hãy giải thích vì sao người ta thường bón vôi bột (CaO) để cải tạo loại đất này.....
Vận dụng 2 trang 22 Hoá học 11: Em hãy tìm hiểu giá trị và ý nghĩa của chỉ số pH ở một số bộ phận trong cơ thể con người.....
Câu hỏi 3 trang 24 Hoá học 11: Để trung hoà 10 mL dung dịch HCl nồng độ x M cần 50 mL dung dịch NaOH 0,5 M. Xác định giá trị của x......
Thí nghiệm trang 24 Hoá học 11: Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1 M) bằng dung dịch chuẩn HCl 0,1 M với chất chỉ thị phenolphthalein.....
Luyện tập 4 trang 24 Hoá học 11: Giải thích vì sao trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl, ta kết thúc chuẩn độ ngay khi dung dịch trong bình tam giác chuyển từ không màu sang hồng (bền trong ít nhất 20 giây).....
Luyện tập 5 trang 24 Hoá học 11: Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH (tính trung bình sau 3 lần chuẩn độ) đã sử dụng ở burette là 10,27 mL. Tính nồng độ của dung dịch NaOH.....
Vận dụng 3 trang 24 Hoá học 11: Nước ép bắp cải tím có nhiều màu sắc phụ thuộc vào pH. Em hãy thiết lập bảng màu của nước ép bắp cải tím theo pH bằng cách sử dụng giấy chỉ thị pH và acid, base thích hợp.....
Bài 1 trang 25 Hoá học 11: Để xác định nồng độ của một dung dịch HCl, người ta tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên.....
Bài 2 trang 25 Hoá học 11: Sưu tầm thông tin về ý nghĩa thực tiễn của pH trong đời sống và trong sản xuất nông nghiệp, công nghiệp.....
Bài 3 trang 25 Hoá học 11: Trong môi trường acid, diệp lục có màu vàng đến đỏ; còn trong môi trường kiềm, diệp lục có màu xanh....
Bài 4 trang 25 Hoá học 11: Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối khoáng chất nhỏ có thể tích tụ trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống liệu quản. Một trong các dấu hiệu của bệnh sỏi thận và nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng bệnh sỏi thận.....
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác:
