Với giải Câu hỏi 2 trang 21 Hóa học lớp 11 Cánh diều chi tiết trong Bài 3: pH của dung dịch. Chuẩn độ acid – base giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Câu hỏi 2 trang 21 Hoá học 11: Giải thích vì sao khi thêm HCl vào nước nguyên chất thì dung dịch thu được có [H+] > 10-7 M
Lời giải:
Nước điện li tạo ra đồng thời cả H+ và OH-:
H2O ⇌ H+ + OH-
Ở 25 oC, nồng độ ion H+ và OH- trong nước là vô cùng nhỏ: [H+] = [OH-] = 10-7 M.
Khi thêm HCl vào nước nguyên chất thì có thêm một lượng H+ từ acid (HCl → H+ + Cl-) nên trong dung dịch có [H+] > [OH-], do đó [H+] > 10-7.
Lý thuyết pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
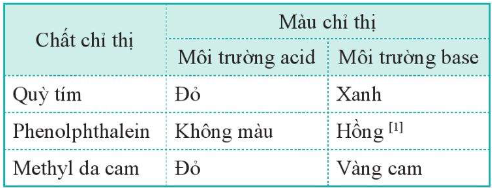
3. Xác định pH bằng chất chỉ thị
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 21 Hoá học 11: Giải thích vì sao nước nguyên chất có môi trường trung tính.....
Luyện tập 1 trang 21 Hoá học 11: Sử dụng máy tính cầm tay để tính:....
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác: