Lời giải bài tập Hóa học lớp 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Bronsted – Lowry về acid - base sách Cánh diều hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 2 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Bronsted – Lowry về acid - base
Lời giải:
Sự khác nhau giữa chất điện li và chất không điện li:
+ Chất điện li là chất khi tan trong nước phân li thành ion.
+ Chất không điện li là chất khi tan trong nước không phân li thành ion.
I. Sự điện li, chất điện li và chất không điện li
Lời giải:
Trong thí nghiệm, đèn sáng hay không sáng chứng tỏ tính dẫn điện của dung dịch chất tan.
+ Đèn sáng chứng tỏ dung dịch chất tan dẫn điện.
+ Đèn không sáng chứng tỏ dung dịch chất tan không dẫn điện.
Lời giải:
Dự đoán trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn không sáng.
Do nước nguyên chất không dẫn điện.
Lời giải:
Chất điện li là chất khi tan trong nước phân li thành ion.
Vậy những chất thuộc loại chất điện li là: HCl, BaCl2, Ca(OH)2, CH3COOH.
II. Thuyết Br∅nsted – Lowry về acid – base
Câu hỏi 2 trang 17 Hoá học 11: Ở quá trình (3b), nước đóng vai trò là acid hay base? Vì sao?
Lời giải:
Quá trình (3b): HCl + H2O → H3O+ + Cl-
Trong quá trình này nước đóng vai trò là base do nhận H+.
H2O + H+ → H3O+.
Luyện tập 3 trang 17 Hoá học 11: Trong cân bằng (4), hãy chỉ ra hai acid và hai base. Giải thích.
Lời giải:
Cân bằng (4):
Trong phản ứng thuận của (4), H2O đã nhường H+ cho NH3 nên đóng vai trò là acid, còn NH3 nhận H+ từ H2O nên đóng vai trò là base.
Trong phản ứng nghịch của (4), NH4+ đã nhường H+ cho OH- nên đóng vai trò là acid, còn OH- nhận H+ từ NH4+ nên đóng vai trò là base.
Vậy trong cân bằng (4):
+ Hai acid là: H2O và NH4+.
+ Hai base là: NH3 và OH-.
Lời giải:
Nước được cho là chất có tính lưỡng tính (là chất vừa có tính acid, vừa có tính base) do nước vừa có khả năng nhường H+ (cân bằng 4) vừa có khả năng nhận H+ (cân bằng 5).
Lời giải:
Acid mạnh và base mạnh phân li hoàn toàn trong nước; Acid yếu và base yếu phân li một phần trong nước. Vậy:
+ Acid mạnh là: HBr và HI
HBr → H+ + Br-
HI → H+ + I-
+ Base mạnh là: KOH
KOH → K+ + OH-
+ Acid yếu là: H2S
H2S ⇌ H+ + HS-
(HS- ⇌ H+ + S2-)
Câu hỏi 4 trang 18 Hoá học 11: Trong các cân bằng (7), (8a) và (8b), xác định các acid và base.
Lời giải:
+ Cân bằng (7): Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
Trong cân bằng (7) Al3+ đóng vai trò là acid; H2O đóng vai trò là base.
+ Cân bằng (8a):
Trong cân bằng (8a) H2O đóng vai trò là acid, CO32- đóng vai trò là base.
+ Cân bằng (8b):
Trong cân bằng (8b) H2O đóng vai trò là acid, HCO3- đóng vai trò là base.
Lời giải:
- Dung dịch phèn sắt (NH4Fe(SO4)2.12H2O) có môi trường acid. Do trong nước, phèn sắt bị phân li hoàn toàn theo phương trình:
NH4Fe(SO4)2.12H2O → NH4+ + Fe3+ + 2SO42- + 12H2O
Ion NH4+ và Fe3+ đóng vai trò là acid trong các cân bằng:
NH4+ + H2O ⇌ NH3 + H3O+ (*)
Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+ (**)
- Người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước bởi ion Fe3+ tạo Fe(OH)3 theo (**) ở dạng kết tủa, có khả năng hấp phụ các chất rồi lắng xuống đáy bể.
Bài tập (trang 19)
a) Chất X là chất điện li.
b) Trong dung dịch chất X có các ion dương và ion âm.
c) Chất X ở trạng thái rắn khan cũng dẫn điện.
d) Trong dung dịch chất X có electron tự do.
Lời giải:
Đáp án đúng là: (c); (d)
Phát biểu (c) không đúng do X ở trạng thái rắn, khan không dẫn điện.
Phát biểu (d) không đúng do dung dịch chất X có các ion dương và ion âm.
Lời giải:
Giả sử nồng độ của dung dịch HCl bằng nồng độ của dung dịch CH3COOH và bằng x M.
HCl là acid mạnh, phân li hoàn toàn trong nước:
HCl → H+ + Cl-
x → x x M
CH3COOH là acid yếu, phân li một phần trong nước:
CH3COOH ⇌ CH3COO- + H+
x M
Suy ra [CH3COO-] = [H+] < x M
Vậy dung dịch HCl dẫn điện tốt hơn dung dịch CH3COOH có cùng nồng độ do trong dung dịch HCl (x M) có nhiều phần tử mang điện hơn dung dịch CH3COOH (x M).
Bài 3 trang 19 Hoá học 11: Giải thích vai trò của nước trong sự điện li của HCl và NaOH.
Lời giải:
Nước là dung môi phân cực, đóng vai trò quan trọng trong sự điện li của HCl và NaOH.
+ Khi tan trong nước, các phân tử HCl hút về chúng những cực ngược dấu của các phân tử nước. Do sự tương tác giữa các phân tử nước và phân tử HCl, kết hợp với sự chuyển động không ngừng của các phân tử nước dẫn đến sự điện li phân tử HCl ra các ion H+ và Cl-.
+ NaOH là hợp chất ion, trong tinh thể có các ion Na+ và OH- liên kết với nhau bằng lực hút tĩnh điện. Nước là dung môi phân cực. Khi cho tinh thể NaOH vào nước, các ion Na+ và OH- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion OH- làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
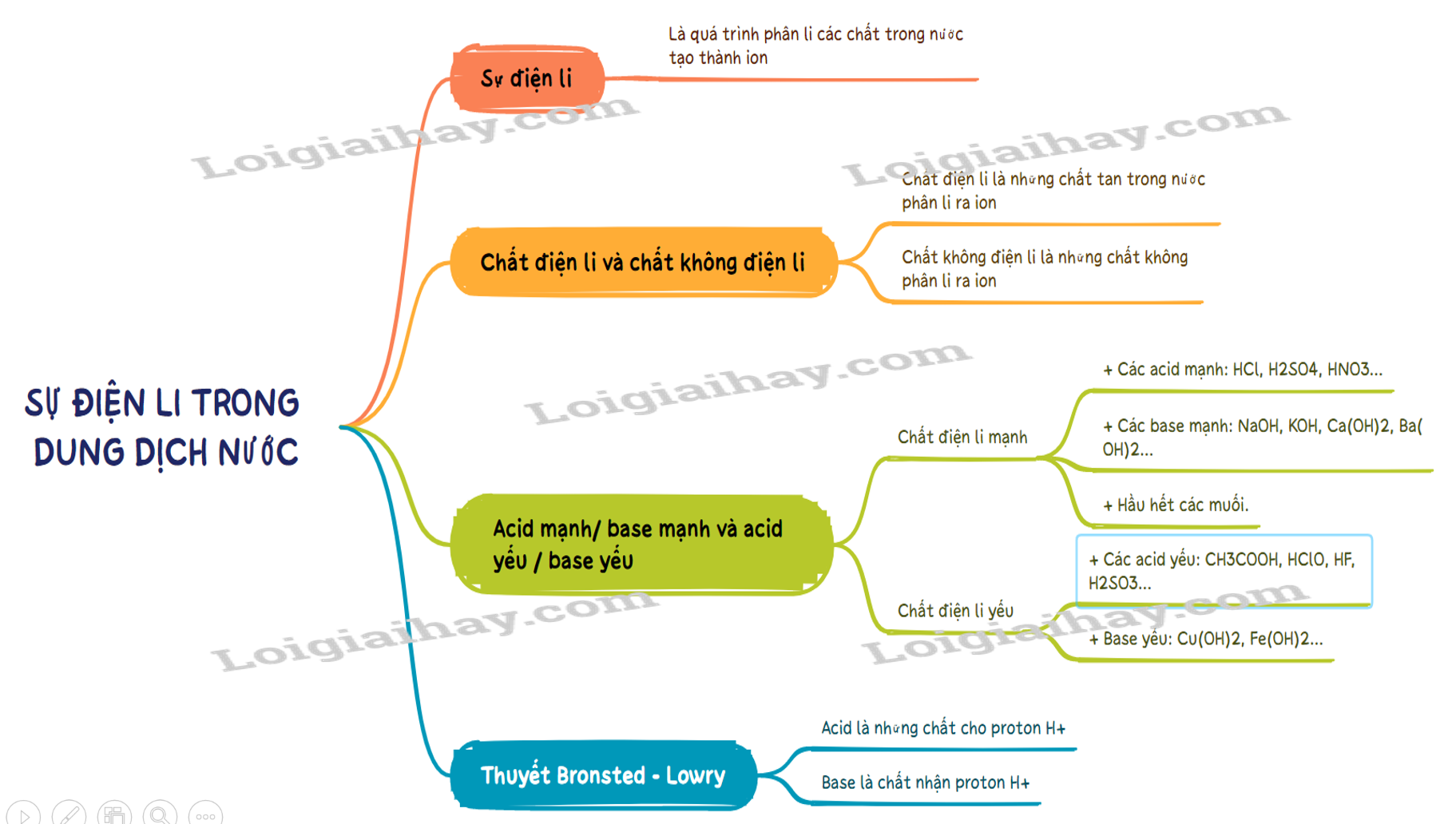
Lý thuyết Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
I. Sự điện li, chất điện li và chất không điện li
1. Sự điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
2. Chất điện li và chất không điện li
- Chất điện li là những chất khi tan trong nước phân li ra các ion
- Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, ..
- Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol….
II. Thuyết Bronsted – Lowry về acid – base
1. Thuyết Bronsted – Lowry về acid – base
a. Khái niệm acid – base theo thuyết Bronsted – Lowry.
- Acid là chất cho proton (H+).
- Base là chất nhận proton (H+).
b. Ưu điểm của thuyết Bronsted – Lowry.
Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH3 hay CO3- cũng là base).
2. Acid mạnh / base mạnh và acid yếu / base yếu
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là:
+ Các acid mạnh: HCl, H2SO4, HNO3…
+ Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2…
+ Hầu hết các muối.
Phản ứng: Một chiều.
Biểu diễn: Mũi tên một chiều (→).
VD: HNO3 → H+ + NO3-.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là:
+ Các acid yếu: CH3COOH, HClO, HF, H2SO3…
+ Base yếu: Cu(OH)2, Fe(OH)2…
Phản ứng: Thuận nghịch.
Biểu diễn: Hai nửa mũi tên ngược nhau (⇆)
VD: CH3COOH ⇆ CH3COO- + H+.
Sơ đồ tư duy Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 1: Mở đầu về cân bằng hoá học
Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base