Với giải Luyện tập 2 trang 85 Hóa học lớp 10 Cánh diều chi tiết trong Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Luyện tập 2 trang 85 Hóa học 10: Tính ∆r các phản ứng đốt cháy hoàn toàn 1 mol mỗi chất C2H4(g), C2H6(g), CO(g). Biết các sản phẩm thu được đều ở thể khí.
Lời giải:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)
∆r = 2 × ∆f (CO2) + 2 × ∆f (H2O) – 1 × ∆f (C2H4) – 3 × ∆f (O2)
∆r = 2 × (-393,5) + 2 × (-241,8) – 1 × 52,4 – 3 × 0 = -1323 kJ
C2H6(g) + O2(g) → 2CO2(g) + 3H2O(g)
∆r = 2 × ∆f (CO2) + 3 × ∆f (H2O) – 1 × ∆f (C2H6) – × ∆f (O2)
∆r = 2 × (-393,5) + 3 × (-241,8) – 1 × (-84) - × 0 = -1428,4 kJ
CO (g) + O2(g) → CO2(g)
∆r = 1 × ∆f (CO2) – 1 × ∆f (CO) – × ∆f (O2)
∆r = 1 × (-393,5) - 1 × (-110,5) - × 0 = -283 kJ
Lý thuyết Cách tính biến thiên enthalpy phản ứng
1. Tính biến thiên enthalpy phản ứng theo enthalpy tạo thành
- Giả sử có phản ứng tổng quát:
aA + bB mM + nN
- Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính theo công thức:
Δr = m× Δf(M) + n× Δf(N) - a× Δf(A) - b× Δf(B)
Trong đó: A, B, M, N là các chất trong phản ứng; a, b, m, n là hệ số tương ứng của các chất.
- Chú ý: Enthalpy tạo thành chuẩn của đơn chất bằng 0.
Ví dụ 1: Cho phản ứng: 2Na2O(s) 4Na(s) + O2(g)
Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính như sau:
Δr = 4× Δf(Na(s)) + 1× Δf(O2(g)) - 2× Δf(Na2O(s))
= 4×0 + 1×0 - 2× (- 418,0) = 836,0 (kJ)
Do Δrcủa phản ứng rất dương nên phản ứng thu nhiệt.
Ví dụ 2: Biến thiên enthalpy của phản ứng đốt cháy hoàn toàn 1 mol C2H6(g) được tính như sau:
C2H6(g) + O2(g) 2CO2(g) + 3H2O(l)
Δr= 2×Δf(CO2(g)) + 3×Δf(H2O(l)) - 1×Δf(C2H6(s)) - ×ΔfO2(g))
= 2×(- 393,5) + 3×(- 285,8) - 1×(- 84) - ×0 = -1560,4 (kJ)
Do Δrủa phản ứng rất âm nên phản ứng tỏa nhiệt mạnh, rất thuận lợi và cung cấp nhiều năng lượng.
2. Tính biến thiên enthalpy phản ứng theo năng lượng liên kết
Khi các chất trong phản ứng ở thể khí, biến thiên enthalpy phản ứng cũng có thể tính được nếu biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
- Giả sử có phản ứng tổng quát:
aA(g) + bB(g) mM(g) + nN(g)
- Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính theo công thức:
Δr = a× Eb(A) + b× Eb(B) - m× Eb(M) - n× Eb(N)
Trong đó Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong các phân tử A, B, M, N.
Lưu ý: Để tính biến thiên enthalpy của phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết.
Ví dụ: Cho phản ứng:
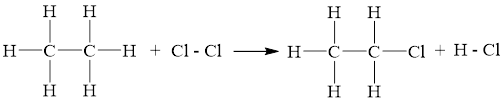
C2H6(g) + Cl2(g) C2H5Cl(g) + HCl(g)
Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính theo năng lượng liên kết như sau:
Δr =1× Eb(C2H6) + 1× Eb(Cl2) - 1× Eb(C2H5Cl) - 1× Eb(HCl)
Δr =1×6EC - H + 1× EC – C + 1×ECl - Cl - 1× (5EC – H + EC – C + EC - Cl) - 1×EH – Cl
Δr= 1×6×414 + 1×347 + 1×243 - 1× (5×414 + 347 + 339) - 1×431 = -113 (kJ)
→ Phản ứng có Δr âm nên phản ứng tỏa nhiệt và diễn ra thuận lợi. Trong thực tế, chỉ cần được chiếu ánh sáng mặt trời là phản ứng đã diễn ra.
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Mở đầu trang 82 Hóa học 10: Cho hai phản ứng đốt cháy:
Luyện tập 1 trang 83 Hóa học 10:Cho phản ứng:
Vận dụng 3 trang 83 Hóa học 10:Vì sao khi nung vôi người ta phải xếp đá vôi lẫn với than trong lò?
Câu hỏi 2 trang 84 Hóa học 10: Phản ứng đốt cháy cồn hay phản ứng nung vôi dễ thực hiện hơn?
Câu hỏi 3 trang 84 Hóa học 10: CaSO4 là thành phần chính của thạch cao. Biết rằng:
Vận dụng 4 trang 85 Hóa học 10: Cho biết:
Câu hỏi 4 trang 85 Hóa học 10:Cho phản ứng sau ở điều kiện chuẩn:
Luyện tập 3 trang 86 Hóa học 10: Dựa vào năng lượng liên kết, tính ∆r các phản ứng sau:
Vận dụng 5 trang 86 Hóa học 10: Phản ứng quang hợp là phản ứng thu năng lượng dưới dạng ánh sáng:
Bài 2 trang 87 Hóa học 10: Tính ∆r cho phản ứng sau dựa theo năng lượng liên kết.
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học