Với giải sách bài tập Hóa học 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải SBT Hóa học lớp 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Lời giải:
- a ghép với 4:
Trong phản ứng thu nhiệt, dấu của ∆H dương vì năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm.
- b ghép với 1:
Trong phản ứng tỏa nhiệt có sự giải phóng năng lượng.
- c ghép với 3:
Trong phản ứng tỏa nhiệt, ∆H có dấu âm vì năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm.
- d ghép với 2:
Trong phản ứng thu nhiệt có sự giải phóng năng lượng.
a) Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt. Vì sao?
b) Viết phương trình hoá học của phản ứng thuỷ phân đường sucrose. Phản ứng trong sơ đồ có phải là phản ứng oxi hoá - khử không? Nếu có, hãy chỉ ra chất oxi hoá và chất khử trong phản ứng và cân bằng phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
c) Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn toả ra một lượng nhiệt là 5 645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hoá sucrose.
d) Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu?
e) Vì sao để duy trì một cơ thể khoẻ mạnh, cần một chế độ dinh dưỡng đầy đủ và luyện tập thể dục thể thao hợp lí?
Lời giải:
a) Phản ứng này là tỏa nhiệt vì có biến thiên enthalpy âm (năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm).
b) Phản ứng thuỷ phân đường sucrose trong môi trường acid và đun nóng:
C12H22O11 + H2O C6H12O6 (glucose) + C6H12O6 (fructose)
Phản ứng trong sơ đồ là phản ứng oxi hóa – khử; trong đó oxygen là chất oxi hóa; đường glucose và fructose là chất khử.
Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
Các quá trình:
Phương trình hóa học:
C6H12O6(g) + 6O2(g) → 6CO2(g) + 6H2O(l)
c) Phản ứng đốt cháy đường sucrose:
C12H22O11(s) + 12O2(g) → 12CO2(g) + 11H2O(l)
Biến thiên enthalpy chuẩn của phản ứng là:
d) Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng:
e) Cơ thể cần năng lượng để hoạt động nên phải có chế độ dinh dưỡng đầy đủ.
Luyện tập thể dục thể thao hợp lý là một phần quan trọng của lối sống lành mạnh. Tập thể dục thể thao giúp hạn chế các vấn đề sức khỏe, giúp cơ thể khỏe mạnh, cung cấp năng lượng, giúp giảm căng thẳng. Bên cạnh đó, còn có thể giúp bạn duy trì một trọng lượng cơ thể hợp lý và kiểm soát sự thèm ăn của bạn.
a) Quá trình tan chảy của nước đá là quá trình thu nhiệt hay toả nhiệt? Vì sao?
b) Vì sao khi cho viên nước đá vào một cốc nước lỏng ấm, viên đá lại tan chảy dần?
c) Vì sao cốc nước lỏng bị lạnh dần trong quá trình viên nước đá tan chảy?
d) Biết rằng để làm cho nhiệt độ của 1 mol nước lỏng thay đổi 1 °C cần một nhiệt lượng là 75,4 J. Giả sử mỗi viên nước đá tương ứng với 1 mol nước, số viên nước đá tối thiểu cần tan chảy để có thể làm lạnh 500 gam nước lỏng ở 20 °C xuống 0 °C là
A. 1.
B. 7.
C. 14.
D. 15.
E. 126.
e) Để làm lạnh 120 gam nước lỏng ở 45 °C xuống 0°C, một bạn học sinh đã dùng 150 gam nước đá. Lượng nước đá này là vừa đủ, thiếu hay dư?
(Trong phần d, e, giả thiết chỉ có sự trao đổi nhiệt giữa nước và nước đá.)
Lời giải:
a) Quá trình tan chảy của nước đá là quá trình thu nhiệt vì có biến thiên enthalpy dương.
b) Khi cho viên nước đá vào một cốc nước lỏng ấm, viên đá tan chảy dần vì nó lấy nhiệt từ nước lỏng (là môi trường xung quanh).
c) Nước lỏng nhường nhiệt cho viên nước đá, sự mất nhiệt làm cho nước lỏng lạnh đi.
d) Nhiệt lượng mà 500 gam nước lỏng từ 20 oC giảm xuống 0 oC tỏa ra là:
Phần nhiệt lượng tỏa ra này được viên nước đá hấp thụ để tan chảy. Số viên nước đá tối thiểu cần là:
viên.
e) Nhiệt lượng tỏa ra khi nhiệt độ của 120 gam nước lỏng từ 45 oC giảm xuống 0 oC là:
Lượng nước đá cần dùng là:
Vậy dùng 150 gam nước đá là dư.
C2H5OH(l) + O2(g) → CO2(g) + H2O(l)(1)
a) Những nhận định nào sau đây là đúng?
(1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng.
(2) Đây là phải là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình phản ứng là 9.
(3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí.
(4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng.
A. (1), (2).
B. (1), (2), (3).
C. (1), (3), (4).
D. (3), (4).
E. (1).
G. (2), (3).
b) Biến thiên enthalpy chuẩn kèm theo quá trình khi 1 mol ethanol lỏng cháy hoàn toàn trong oxygen là , xác định enthalpy hình thành chuẩn của C2H5OH (lỏng).
(Những số liệu cần thiết được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
Lời giải:
a) Đáp án đúng là: G
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)(1)
Phát biểu (1) sai vì để xét phản ứng tỏa nhiệt hay thu nhiệt cần dựa vào năng lượng hóa học của phản ứng.
Phát biểu (2) đúng, tổng hệ số cân bằng của phản ứng là 1 + 3 + 2 + 3 = 9.
Phát biểu (3) đúng.
Phát biểu (4) sai, sản phẩm của phản ứng chiếm một số mol lớn hơn so với chất phản ứng.
Những phát biểu nào sau đây là đúng?
A. Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ.
B. Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ mol-1.
C. Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
D. 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45 kJ năng lượng dưới dạng nhiệt.
E. 32 gam sulfur cháy hoàn toàn tỏa ra một lượng nhiệt là 2,969 × 105 J.
Lời giải:
Đáp án đúng là: B, C, D, E
A sai vì: Biến thiên enthalpy chuẩn của phản ứng là -296,9 kJ.
Bài 15.6 trang 46 sách bài tập Hóa học 10: Phản ứng luyện gang trong lò cao có phương trình như sau:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g) (1)
a) Cân bằng phương trình hóa học của phản ứng (1) và tính biến thiên enthalpy chuẩn của phản ứng với các hệ số cân bằng tương ứng.
b) Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng (1) với hiệu suất 100% thì giải phóng một lượng nhiệt là
A. 8,27 kJ.
B. 49,6 kJ.
C. 12,4 kJ.
D. 74,4 kJ.
(Các số liệu cần thiết tra trong Phụ lục 3, SGK Hóa học 10, Cánh Diều.)
Lời giải:
a)
Phương trình hóa học: Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Biến thiên enthalpy chuẩn của phản ứng:
b) Đáp án đúng là: A
Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Theo phương trình hóa học ta có CO hết, Fe2O3 dư, tính toán theo mol CO.
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng (1) với hiệu suất 100% thì giải phóng một lượng nhiệt là
a) Viết và cân bằng phương trình hóa học của phản ứng. Đây có phải là phản ứng oxi hóa – khử không? Vì sao?
b) Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng trên thu nhiệt hay tỏa nhiệt?
c) Tính lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành.
d) Nếu muốn tạo ra được 1,0 kJ nhiệt lượng cần bao nhiêu gam Al phản ứng?
Lời giải:
a) Phương trình hóa học của phản ứng:
2Al(s) + 3Cl2(g) → 2AlCl3(g)
Đây là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của các nguyên tử trong phản ứng.
b) Biến thiên enthalpy chuẩn của phản ứng:
Phản ứng trên tỏa nhiệt.
c) Cứ 1 mol AlCl3 tạo thành giải phóng:
Lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành là:
d) Cứ 1 mol Al phản ứng giải phóng:
Nếu muốn tạo ra được 1,0 kJ nhiệt lượng cần khối lượng Al phản ứng là:
a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
b) 6CH4 → C6H6 (1,3,5 – cyclohexatriene) + 9H2
Cho biết công thức cấu tạo của 1,3,5 – cyclohexatriene như sau:
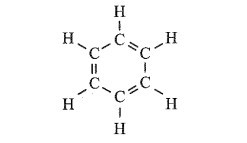
Các phản ứng trên có thuận lợi về phương diện nhiệt hay không? Phản ứng theo chiều ngược lại có biến thiên enthalpy bằng bao nhiêu?
Lời giải:
a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
b) 6CH4 → C6H6 + 9H2
Các phản ứng này không thuận lợi về phương diện nhiệt.
Phản ứng theo chiều ngược lại thuận lợi về phương diện nhiệt:
CH2 = CH – CH = CH2 + 2H2 → H3C – CH2 – CH2 – CH3
C6H6 + 9H2 → 6CH4
H3C – CH2 – OH (g) → H3C – O – CH3 (g)
Lời giải:
CH3CH2OH có 1 liên kết C – C; 5 liên kết C – H; 1 liên kết C – O và 1 liên kết O – H.
CH3OCH3 có 6 liên kết C – H và 2 liên kết C – O.
Quá trình đã cho có biến thiên enthalpy chuẩn là:
chứng tỏ ở điều kiện chuẩn CH3CH2OH bền hơn CH3OCH3.
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
a) Từ các giá trị của enthapyl hình thành chuẩn, hãy tính biến thiên enthalpy chuẩn của các phản ứng thế trên.

(Các giá trị khác được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
b) Nhận xét sự thuận lợi về phương diện nhiệt của các phản ứng thế trong dãy halogen. Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học không?
Lời giải:
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
b) Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học.
Cụ thể, các giá trị biến thiên enthalpy chuẩn đều âm thể hiện quá trình diễn ra thuận lợi về phương diện nhiệt; quy luật tính chất oxi hóa của X: halogen có tính oxi hóa mạnh đẩy được halogen có tính oxi hóa yếu hơn ra khỏi muối của nó.
Xét các phản ứng thế trong dãy halogen ở điều kiện chuẩn:
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
a) Từ các giá trị của enthapyl hình thành chuẩn, hãy tính biến thiên enthalpy chuẩn của các phản ứng thế trên.

(Các giá trị khác được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
b) Nhận xét sự thuận lợi về phương diện nhiệt của các phản ứng thế trong dãy halogen. Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học không?
Lời giải:
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
b) Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học.
Cụ thể, các giá trị biến thiên enthalpy chuẩn đều âm thể hiện quá trình diễn ra thuận lợi về phương diện nhiệt; quy luật tính chất oxi hóa của X: halogen có tính oxi hóa mạnh đẩy được halogen có tính oxi hóa yếu hơn ra khỏi muối của nó.
Liên hệ giữa mức độ thuận lợi của phản ứng (qua ) với những vấn đề thực nghiệm nêu trên.
Lời giải:
Vì các phản ứng (2) và (3) lần lượt có âm hơn phản ứng (1) và (4) nên sự hình thành HbCO thuận lợi hơn sự tạo thành HbO2. Do vậy không có sự nhả O2 và giải phóng Hb như trường hợp không có CO. Điều này giải thích sự ngộ độc CO trong máu.
Xem thêm các bài giải SBT Hoá học lớp 10 Cánh diều hay, chi tiết khác:
Bài 14: Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid
Lý thuyết Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
I. Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng
Với các phản ứng có kèm theo sự trao đổi năng lượng dưới dạng nhiệt, có hai khả năng sau đây:
- Phản ứng tỏa nhiệt: biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
- Phản ứng thu nhiệt: biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
- Với phản ứng tỏa nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm, do vậy phản ứng diễn ra kèm theo sự giải phóng năng lượng dưới dạng nhiệt.
- Với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm, do vậy phản ứng diễn ra kèm theo sự hấp thu năng lượng dưới dạng nhiệt.
Ví dụ: Cho phản ứng đốt cháy methane và acetylene:
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) Δr= -890,5 kJmol-1
C2H2(g) + O2(g) 2CO2(g) + H2O(l) Δr= -1300,2 kJmol-1
Với chất khí trong cùng điều kiện nhiệt độ và áp suất, tỉ lệ về số mol bằng tỉ lệ thể tích nên khi đốt cháy cùng một thể tích CH4 và C2H2, lượng nhiệt do C2H2 sinh ra nhiều gấp khoảng 1,5 lần lượng nhiệt do CH4 sinh ra. Thực tế, người ta sử dụng C2H2 trong đèn xì để hàn, cắt kim loại mà không dùng CH4.

Hình 15.1. Đèn xì acetylene dùng để hàn, cắt kim loại
- So sánh phản ứng thu nhiệt và phản ứng tỏa nhiệt:
|
Loại phản ứng Giai đoạn |
Phản ứng thu nhiệt |
Phản ứng tỏa nhiệt |
|
Giai đoạn khơi mào |
Hầu hết các phản ứng cần thiết khơi mào (đun hoặc đốt nóng, …). |
Có thể có hoặc không cần khơi mào, tùy phản ứng cụ thể. |
|
Giai đoạn tiếp diễn |
Hầu hết các phản ứng cần phải tiếp tục đun hoặc đốt nóng. |
Hầu hết các phản ứng không cần tiếp tục đun hoặc đốt nóng. |
|
Ví dụ |
Phản ứng nung vôi cần nhiệt từ quá trình đốt cháy than, nếu dừng cung cấp nhiệt thì phản ứng nung vôi sẽ không tiếp diễn.
|
- Phản ứng cần khơi mào: phản ứng cháy, nổ, … sau đó, phản ứng tỏa nhiệt có thể tự tiếp diễn mà không cần tiếp tục đun nóng. - Phản ứng không cần khơi mào: phản ứng tạo gỉ sắt, gỉ đồng, phản ứng trung hòa acid – base, tôi vôi, ... |
Lưu ý: Các phản ứng tỏa nhiệt (Δr < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (Δr >0).
Ví dụ: Sau khi được đốt nóng, Na tự cháy trong chlorine cho đến hết do phản ứng này có Δrrất âm.
Na(s) + Cl2(g) NaCl(s) Δr = - 411,2 kJmol-1
® Phản ứng này diễn ra thuận lợi hơn rất nhiều so với phản ứng giữa N2 và O2. Ở điều kiện chuẩn, phản ứng chỉ xảy ra khi được đốt nóng đến khoảng 3000oC (cung cấp nhiệt), khi dừng đốt nóng phản ứng sẽ dừng lại.
N2(s) + O2(g) NO(g) Δr = 91,3 kJmol-1
II. Cách tính biến thiên enthalpy phản ứng
1. Tính biến thiên enthalpy phản ứng theo enthalpy tạo thành
- Giả sử có phản ứng tổng quát:
aA + bB mM + nN
- Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính theo công thức:
Δr = m× Δf(M) + n× Δf(N) - a× Δf(A) - b× Δf(B)
Trong đó: A, B, M, N là các chất trong phản ứng; a, b, m, n là hệ số tương ứng của các chất.
- Chú ý: Enthalpy tạo thành chuẩn của đơn chất bằng 0.
Ví dụ 1: Cho phản ứng: 2Na2O(s) 4Na(s) + O2(g)
Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính như sau:
Δr = 4× Δf(Na(s)) + 1× Δf(O2(g)) - 2× Δf(Na2O(s))
= 4×0 + 1×0 - 2× (- 418,0) = 836,0 (kJ)
Do Δrcủa phản ứng rất dương nên phản ứng thu nhiệt.
Ví dụ 2: Biến thiên enthalpy của phản ứng đốt cháy hoàn toàn 1 mol C2H6(g) được tính như sau:
C2H6(g) + O2(g) 2CO2(g) + 3H2O(l)
Δr= 2×Δf(CO2(g)) + 3×Δf(H2O(l)) - 1×Δf(C2H6(s)) - ×ΔfO2(g))
= 2×(- 393,5) + 3×(- 285,8) - 1×(- 84) - ×0 = -1560,4 (kJ)
Do Δrủa phản ứng rất âm nên phản ứng tỏa nhiệt mạnh, rất thuận lợi và cung cấp nhiều năng lượng.
2. Tính biến thiên enthalpy phản ứng theo năng lượng liên kết
Khi các chất trong phản ứng ở thể khí, biến thiên enthalpy phản ứng cũng có thể tính được nếu biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
- Giả sử có phản ứng tổng quát:
aA(g) + bB(g) mM(g) + nN(g)
- Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính theo công thức:
Δr = a× Eb(A) + b× Eb(B) - m× Eb(M) - n× Eb(N)
Trong đó Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong các phân tử A, B, M, N.
Lưu ý: Để tính biến thiên enthalpy của phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết.
Ví dụ: Cho phản ứng:
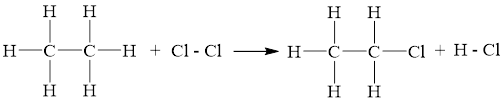
C2H6(g) + Cl2(g) C2H5Cl(g) + HCl(g)
Biến thiên enthalpy chuẩn phản ứng của phản ứng được tính theo năng lượng liên kết như sau:
Δr =1× Eb(C2H6) + 1× Eb(Cl2) - 1× Eb(C2H5Cl) - 1× Eb(HCl)
Δr =1×6EC - H + 1× EC – C + 1×ECl - Cl - 1× (5EC – H + EC – C + EC - Cl) - 1×EH – Cl
Δr= 1×6×414 + 1×347 + 1×243 - 1× (5×414 + 347 + 339) - 1×431 = -113 (kJ)
→ Phản ứng có Δr âm nên phản ứng tỏa nhiệt và diễn ra thuận lợi. Trong thực tế, chỉ cần được chiếu ánh sáng mặt trời là phản ứng đã diễn ra.