Với lời giải SBT Hóa học 11 trang 47 chi tiết trong Bài 12: Công thức phân tử hợp chất hữu cơ sách Kết nối tri thức giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 12: Công thức phân tử hợp chất hữu cơ
Bài 12.7 trang 47 Sách bài tập Hóa học 11: Một hợp chất hữu cơ A chứa 32% C, 4% H và 64% O về khối lượng. Biết một phân tử A có 6 nguyên tử oxygen, công thức phân tử của A là
A. C2H3O3.
B. C4H6O6.
C. C6H12O6.
D. C6H4O6.
Lời giải:
Đáp án đúng là: B
Đặt công thức phân tử của A: CxHyOz.
Tỉ lệ mol các nguyên tố:
Công thức thực nghiệm của chất A là C2H3O3.
Vì một phân tử A có 6 nguyên tử oxygen, nên công thức phân tử của A là C4H6O6.
Bài 12.8 trang 47 Sách bài tập Hóa học 11: Một hợp chất hữu cơ X chứa 37,5% C, 3,2% H và 59,3% F về khối lượng. Cho bay hơi 1,00 g chất này tại 90oC với áp suất 0,50 bar thì thể tích thu được là 0,93 L. Xác định công thức phân tử của X.
Lời giải:
Đặt công thức phân tử của X: CxHyFz.
Tỉ lệ mol các nguyên tố:
Công thức thực nghiệm của chất này là CHF.
nx = 0,0156 mol.
Khối lượng mol của phân tử X:
Công thức phân tử của X là C2H2F2.
Bài 12.9 trang 47 Sách bài tập Hóa học 11: Vitamin C (ascorbic acid) chứa 40,92% C, 4,58% H và 54,50% O về khối lượng. Hình sau đây là phổ khối lượng của ascorbic acid:
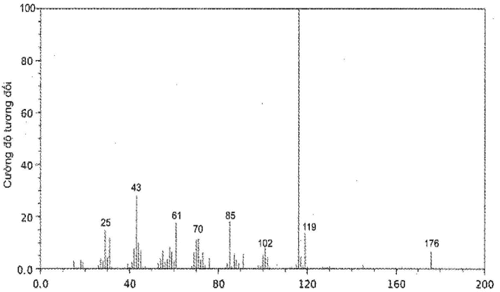
Xác định công thức thực nghiệm và công thức phân tử của ascorbic acid.
Lời giải:
Đặt công thức phân tử vitamin C là: CxHyOz.
Tỉ lệ mol các nguyên tố:
Công thức thực nghiệm của ascorbic acid là C3H4O3.
Phổ khối lượng của ascorbic acid cho thấy phân tử khối của ascorbic acid bằng 176.
Công thức phân tử của ascorbic acid là C6H8O6.
Bài 12.10 trang 47 Sách bài tập Hóa học 11: Đốt cháy 20,63 mg hợp chất Y, chỉ chứa C, H và O, bằng lượng dư khí oxygen tạo 57,94 mg CO2 và 11,85 mg H2O.
a) Tính khối lượng (theo mg) của C, H và O trong hợp chất Y.
b) Xác định công thức thực nghiệm của Y.
c) Dựa trên phổ khối lượng của Y như hình cho dưới đây, xác định công thức phân tử của Y.
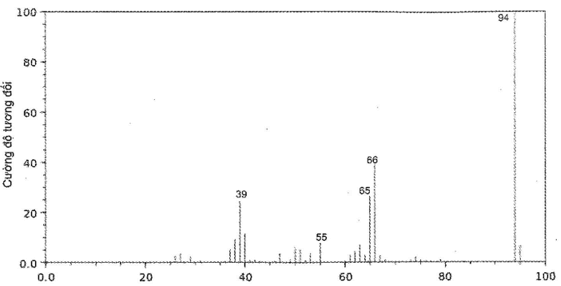
Lời giải:
a) Khối lượng các nguyên tố:
b) Tỉ lệ mol các nguyên tố:
Công thức thực nghiệm của Y là C6H6O.
c) Phổ khối lượng của chất Y cho thấy phân tử khối của chất Y bằng 94.
Công thức phân tử của Y là C6H6O.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 12.1 trang 45 Sách bài tập Hóa học 11: Công thức phân tử cho biết thông tin nào sau đây về phân tử hợp chất hữu cơ?...
Bài 12.2 trang 45 Sách bài tập Hóa học 11: Công thức nào sau đây là công thức phân tử của acetic acid?...
Bài 12.3 trang 45 Sách bài tập Hóa học 11: Công thức phân tử của methyl formate và glucose lần lượt là C2H4O2 và C6H12O6. Công thức đơn giản nhất của hai chất này là...
Bài 12.4 trang 46 Sách bài tập Hóa học 11: Trong phương pháp phổ khối lượng, đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị ...... của chất nghiên cứu. Cụm từ thích hợp điền vào chỗ trống là....
Bài 12.5 trang 46 Sách bài tập Hóa học 11: Hình sau đây là phổ khối lượng của phân tử acetic acid....
Bài 12.6 trang 46 Sách bài tập Hóa học 11: Hình sau đây là phổ khối lượng của phân tử benzene...
Bài 12.7 trang 47 Sách bài tập Hóa học 11: Một hợp chất hữu cơ A chứa 32% C, 4% H và 64% O về khối lượng. Biết một phân tử A có 6 nguyên tử oxygen, công thức phân tử của A là....
Bài 12.8 trang 47 Sách bài tập Hóa học 11: Một hợp chất hữu cơ X chứa 37,5% C, 3,2% H và 59,3% F về khối lượng. Cho bay hơi 1,00 g chất này tại 90oC với áp suất 0,50 bar thì thể tích thu được là 0,93 L. Xác định công thức phân tử của X....
Bài 12.9 trang 47 Sách bài tập Hóa học 11: Vitamin C (ascorbic acid) chứa 40,92% C, 4,58% H và 54,50% O về khối lượng. Hình sau đây là phổ khối lượng của ascorbic acid:...
Bài 12.10 trang 47 Sách bài tập Hóa học 11: Đốt cháy 20,63 mg hợp chất Y, chỉ chứa C, H và O, bằng lượng dư khí oxygen tạo 57,94 mg CO2 và 11,85 mg H2O....
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 11: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Bài 12: Công thức phân tử hợp chất hữu cơ
Bài 13: Cấu tạo hoá học hợp chất hữu cơ
Bài 14: Ôn tập chương 3