Với giải sách bài tập Hoá học 10 Bài 1: Thành phần của nguyên tử sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 1: Thành phần của nguyên tử
Nhận biết
Bài 1.1 trang 4 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
C. Hạt nhân nguyên tử cấu thành từ các hạt proton và neutron.
D. Vỏ nguyên tử cấu thành từ các hạt electron.
Lời giải:
Đáp án đúng là: B
Nguyên tử có cấu trúc rỗng, gồm gồm hạt nhân ở tâm (chứa proton mang điện tích dương và neutron không mang điện) và vỏ nguyên tử (chứa các electron mang điện tích âm).
A. Proton, m ≈ 0,00055 amu, q = +1.
B. Neutron, m ≈ 1 amu, q = 0
C. Electron, m ≈ 1 amu, q = -1
D. Proton, m≈ 1 amu, q = -1
Lời giải:
Đáp án đúng là: B
Sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng là:
Neutron, m ≈ 1 amu, q = 0
Proton, m≈ 1 amu, q = +1
Electron, m ≈ 0,00055 amu, q = -1
A. 102 pm
B. 10-4 pm
C. 10-2 pm
D. 104 pm
Lời giải:
Đáp án đúng là: C
Kích thước của nguyên tử lớn hơn khoảng 10 000 lần kích thước của hạt nhân nguyên tử.
Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân chỉ khoảng10-2 pm.
|
Nguyên tố |
Kí hiệu |
Z |
Số e |
Số p |
Số n |
Số khối |
|
Carbon |
C |
6 |
6 |
? |
6 |
? |
|
Nitrogen |
N |
7 |
? |
7 |
? |
14 |
|
Oxygen |
O |
8 |
8 |
? |
8 |
? |
|
Sodium (natri) |
Na |
11 |
? |
11 |
? |
23 |
Lời giải:
Em cần nhớ:
+ Số e = số p
+ Số khối = số p + số n
|
Nguyên tố |
Kí hiệu |
Z |
Số e |
Số p |
Số n |
Số khối |
|
Carbon |
C |
6 |
6 |
6 |
6 |
12 |
|
Nitrogen |
N |
7 |
7 |
7 |
7 |
14 |
|
Oxygen |
O |
8 |
8 |
8 |
8 |
16 |
|
Sodium (natri) |
Na |
11 |
11 |
11 |
12 |
23 |
Thông hiểu
Lời giải:
- Có thể tạo ra chùm electron bằng cách phóng điện với hiệu điện thế rất cao (khoảng 10000V) qua không khí loãng (khoảng 1,3.10-6 bar).
- Khối lượng của electron bằng 9,109.10-31 (kg)
- Điện tích electron bằng -1,602.10-19 (C)
A. 19
B. 28
C. 30
D. 32
Lời giải:
Đáp án đúng là: B
Số hạt electron = số hạt proton = 9
Số khối A = Số proton + số neutron
⇒ Số neutron = 19 – 9 = 10
⇒Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là:
9 + 9 + 10 = 28 hạt.
A. 23,978
B. 66,133.10-51
C. 24,000
D. 23,985.10-3
Lời giải:
Đáp án đúng là: A
1 amu = 1,661.10-27 kg
Khối lượng của magnesium theo amu là: ≈ 23,978 amu
Lời giải:
1 amu = 1,661.10-27 kg
Khối lượng của nguyên tử oxygen theo amu là: ≈ 15,99 amu
Khối lượng mol của oxygen là 15,99 g/mol.
Vận dụng
A. 3
B. 4
C. 6
D. 7
Lời giải:
Đáp án đúng là: D
Với các nguyên tử bền ta có: 1 ≤ ≤ 1,52 (1)
Theo bài ra có:
2Z + N = 10 ⇒ N = 10 – 2Z, thay vào (1) ta có:
⇔ Z ≤ 10 – 2Z ≤ 1,52Z
⇔ 2,84 ≤ Z ≤ 3,33
Chọn Z = 3 ⇒ N = 4
Số khối của X bằng Z + N = 7
A. 2,72%
B. 0,272%
C. 0,0272%
D. 0,0227%
Lời giải:
Đáp án đúng là: C
Cách 1:
Ta có: me = 0,00055u; mn ≈ mp ≈ 1u.
Vậy %me =
Cách 2:
Ta có: me = 9,109.10-31 kg; mn = 1,675.10-27 kg; mp = 1,673.10-27 kg.
Vậy %me =
Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12.
a) Tính số hạt mỗi loại (proton, electron, neutron) trong nguyên tử X.
b) Tính số khối của nguyên tử X.
Lời giải:
Lời giải:
a) Nguyên tử trung hòa về điện nên p = e.
Theo bài ra ta có: p + e + n = 40 hay 2p + n = 40 (1)
và 2p – n = 12 (2)
Giải hệ hai phương trình (1) và (2)
⇒ p = e = 13 và n = 14
b) Số khối của X là: p + n = 13 + 14 = 27
Lời giải:
Số electron = số proton = 13
Số mol nhôm = 1 mol tương ứng với 6,022.1023 nguyên tử.
⇒ Khối lượng proton là: 13.1,673.10-24.6,022.1023 = 13,0972 (g)
Khối lượng neutron là: 14.1,675.10-24.6,022.1023 = 14,1216 (g).
Khối lượng electron là: 13.9,109.10-28.6,022.1023 = 7,131.10-3 (g).
Lời giải:
Trong nguyên tử B: số p = số e = 5; số n = 6.
Khối lượng hạt nhân nguyên tử boron (B) là:
mp + mn = 5. 1,673.10-24 + 6. 1,675.10-24 = 1,8415.10-23 (g)
Khối lượng nguyên tử B là:
mp + mn + me = 5. 1,673.10-24 + 6. 1,675.10-24 + 5.9,109.10-28 = 1,8422.10-23 (kg)
Tỉ số khối lượng nguyên tử: khối lượng hạt nhân = 1,0003
⇒ Khối lượng nguyên tử tập chung chủ yếu ở hạt nhân.
Bài giảng Hóa học 10 Bài 1: Thành phần của nguyên tử - Kết nối tri thức
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 1: Thành phần của nguyên tử
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Thành phần của nguyên tử
I. Các loại hạt cấu tạo nên nguyên tử
Năm 1897, J. J. Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm. Đó chính là chùm các hạt electron. Electron là một thành phần của nguyên tử.
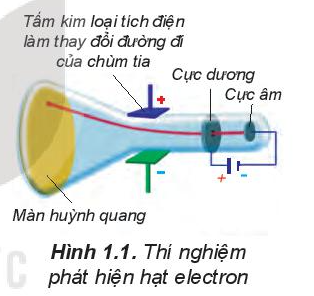
Năm 1911, E.Rutherford thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt a (alpha).
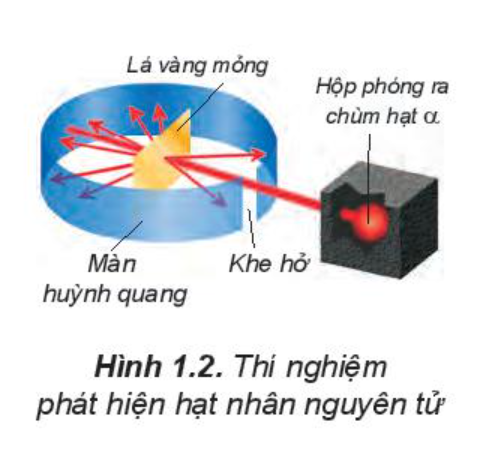
Kết quả thí nghiệm: hầu hết các hạt a đều xuyên thẳng qua lá vàng, chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử.
Năm 1918, E.Rutherford và các cộng sự khi dùng hạt a bắn phá nitrogen đã phát hiện ra hạt proton.
Năm 1932, J. Chadwick, cộng sự của Rutherford, đã phát hiện ra hạt neutron khi bắn phá berylium bằng các hạt a.
Kết luận:
Thành phần cấu tạo của nguyên tử gồm:
- Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp ).
- Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử:
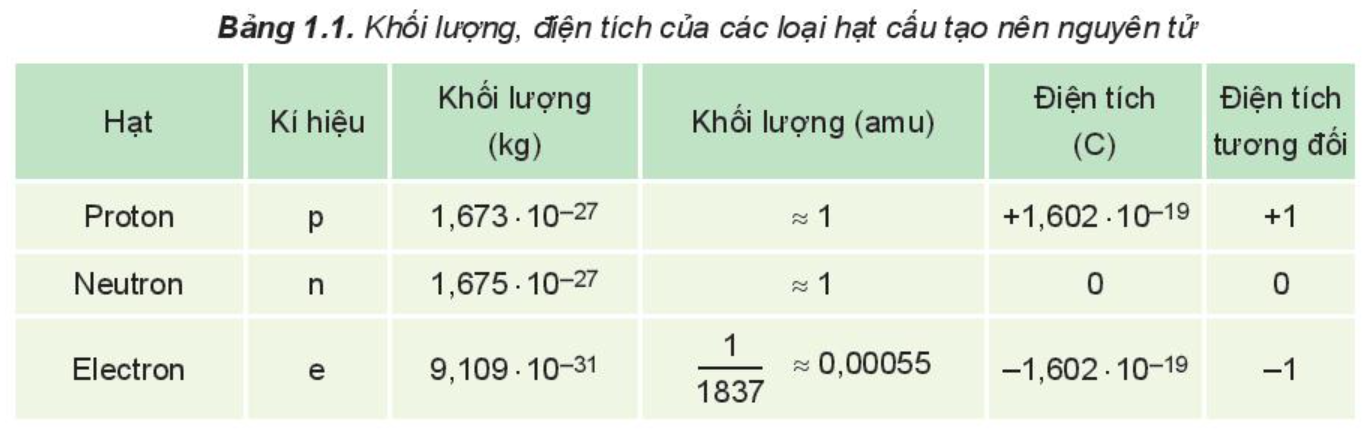
Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hòa về điện.
Khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của proton hay neutron nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân.
II. Kích thước và khối lượng của nguyên tử
1. Kích thước
Kích thước của nguyên tử rất nhỏ nên thường được biểu diễn bằng đơn vị picomet (pm) hay Angstrom (Å).
1 pm = 10-12 m; 1 = 10-10 m
Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử.
2. Khối lượng
Khối lượng nguyên tử bằng tổng khối lượng các hạt proton, neutron và electron có trong nguyên tử.
Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu.
1 amu = 1,661×10-27 kg
Ví dụ: Một nguyên tử oxygen có khối lượng là 2,656×10-26 kg.
1 amu = 1,661×10-27 kg nên khối lượng của một nguyên tử oxygen là: (amu).
III. Điện tích hạt nhân và số khối
- Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử Na có 11 proton nên số đơn vị điện tích hạt nhân là Z = 11.
- Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Ví dụ: Hạt nhân nguyên tử Na có 11 proton và 12 neutron.
Số khối của hạt nhân nguyên tử Na là: A = 11 + 12 = 23.