Với giải sách bài tập Hoá học 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Nhận biết
Bài 3.1 trang 7 SBT Hóa học 10: Orbital nguyên tử là
A. Đám mây chứa electron dạng hình cầu.
B. Đám mây chứa electron có dạng hình số 8 nổi.
C. Khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. Quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
Lời giải:
Đáp án đúng là: C
Orbital nguyên tử làkhu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
A. Nguyên lí vững bền.
B. Quy tắc Hund
C. Nguyên lí Pauli
D. Quy tắc Pauli
Lời giải:
Đáp án đúng là: C
Sự phân bố electron trong một orbital dựa vào nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
A. Nguyên lí vững bền và nguyên lí Pauli.
B. Nguyên lí vững bền và quy tắc Hund.
C. Nguyên lí Pauli và quy tắc Hund.
D. Nguyên lí vững bền và quy tắc Pauli
Lời giải:
Đáp án đúng là: B
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí vững bền và quy tắc Hund.
+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
+ Quy tắc Hund: Trong cùng một lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Bài 3.4 trang 8 SBT Hóa học 10: Sự phân bố electron vào các lớp và phân lớp căn cứ vào
A. nguyên tử khối tăng dần.
B. điện tích hạt nhân tăng dần.
C. số khối tăng dần.
D. mức năng lượng electron.
Lời giải:
Đáp án đúng là: D
Sự phân bố electron vào các lớp và phân lớp căn cứ vàomức năng lượng electron.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
A. lần lượt từ cao đến thấp.
B. lần lượt từ thấp đến cao.
C. bất kì.
D. từ mức thứ hai trở đi.
Lời giải:
Đáp án đúng là: B
Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng lần lượt từ thấp đến cao.
A. K, L, M, O, ...
B. L, M, N, O, ...
C. K, L, M, N, ...
D. K, M, N, O, ...
Lời giải:
Đáp án đúng là: C
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
A. s, d, p, f, ...
B. s, p, d, f, ..
C. s, p, f, d, ...
D. f, d, p, s, ...
Lời giải:
Đáp án đúng là: B
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ tự làs, p, d, f, …
Bài 3.8 trang 8 SBT Hóa học 10: Phát biểu nào sau đây đúng?
A. Những electron ở lớp K có mức năng lượng thấp nhất.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
D. Các electron trong cùng một lớp có năng lượng bằng nhau.
Lời giải:
Đáp án đúng là: A
- Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân.
⇒ B sai, A đúng vì lớp K là lớp gần hạt nhân nhất.
- Electron ở orbital 3p có mức năng lượng cao hơn electron ở orbital 3s⇒ C sai
- Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau ⇒ D sai
Bài 3.9 trang 8 SBT Hóa học 10: Mỗi orbital nguyên tử chứa tối đa
A. 1 electron
B. 2 electron
C. 3 electron
D. 4 electron
Lời giải:
Đáp án đúng là: B
Mỗi orbital nguyên tử chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí loại trừ Pauli)
Bài 3.10 trang 8 SBT Hóa học 10: Số orbital trong các phân lớp s, p, d lần lượt bằng
A. 1, 3, 5.
B. 1, 2, 4.
C. 3, 5, 7.
D. 1, 2, 3.
Lời giải:
Đáp án đúng là: A
Phân lớp s có 1 AO
Phân lớp p có 3 AO
Phân lớp d có 5 AO
Thông hiểu
Bài 3.11 trang 9 SBT Hóa học 10: Phân lớp 3d có số electron tối đa là
A. 6
B. 18
C. 14
D. 10
Lời giải:
Đáp án đúng là: D
Phân lớp d có 5 AO. Mỗi AO chứa tối đa 2 electron
⇒Phân lớp 3d có số electron tối đa là 5.2 = 10 electron.
Bài 3.12 trang 9 SBT Hóa học 10: Lớp L có số phân lớp electron bằng
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: B
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
Phân lớp L (n = 2) có 2 phân lớp là 2s và 2p.
Bài 3.13 trang 9 SBT Hóa học 10: Lớp M có số orbital tối đa bằng
A. 3
B. 4
C. 9
D. 18
Lời giải:
Đáp án đúng là: C
Trong lớp electron thứ n có n2 AO (n ≤ 4)
Lớp M (n = 3) có 32 = 9 AO
Bài 3.14 trang 9 SBT Hóa học 10: Lớp M có số electron tối đa bằng
A. 3
B. 4
C. 9
D. 18
Lời giải:
Đáp án đúng là: D
Trong lớp electron thứ n có n2 AO (n ≤ 4)
Mỗi AO chứa tối đa 2 electron
⇒Lớp M (n = 3) có số electron tối đa bằng 2.32 =18 electron.
A. 6
B. 8
C. 14
D. 16
Lời giải:
Đáp án đúng là: D
Theo chiều tăng của mức năng lượng: 1s 2s 2p 3s 3p 4s …
Lớp thứ 3 có 6 electron ⇒ 2 electron được điền vào 3s và 4 electron được điền vào 3p
Cấu hình electron của X là: 1s2 2s2 2p6 3s2 3p4
A. K
B. L
C. M
D. N
Lời giải:
Đáp án đúng là: C
Xcó Z = 17 nên nguyên tử X có 17 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p5.
⇒ Cấu hình electron của nguyên tử X là: 1s22s22p63s23p5.
⇒ Electron lớp ngoài cùng của X thuộc lớp thứ 3 (lớp M)
Lời giải:
Đáp án đúng là: B và D
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên, nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
Bài 3.18 trang 9 SBT Hóa học 10: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Lời giải:
Đáp án đúng là: B
Sự phân bố electron theo ô orbital trên các lớp và phân lớp cần tuân theo nguyên lí Pauli và quy tắc Hund.
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
⇒ A, D sai.
+ Quy tắc Hund: Trong cùng một lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
⇒ B đúng, C sai (vì số electron độc thân chưa đạt tối đa)
Bài 3.19 trang 9 SBT Hóa học 10: Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s.
Lời giải:
Nếu orbital s chỉ chứa 1 electron:
Nếu orbital s chứa 2 electron:
Chú ý: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí Pauli). Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên (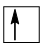
)
Lời giải:
Trường hợp orbital p có chứa 2 electron, có rất nhiều cách để biểu diễn 2 electron trong AOp. Ví dụ một số cách:
Tuy có nhiều cách biểu diễn nhưng chỉ có trường hợp (2) tuân theo quy tắc Hund (số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau).
Chú ý: Theo nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau. Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên (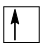
)
Lời giải:
Mối quan hệ về năng lượng:
- Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân. Mức năng lượng tăng dần theo lớp electron: K < L < M < N < O < …
- Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau. Mức năng lượng tăng dần theo AO: s < p < d < f.
- Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Bài 3.22 trang 9 SBT Hóa học 10: Cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p;
b) Phân lớp d;
c) Lớp K;
d) Lớp M.
Lời giải:
Chú ý:
+ Lớp electron thứ n có n2 AO (n ≤ 4)
+ Mỗi AO chứa tối đa 2 electron
a) Phân lớp p có 3 AO px, py, pz
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp p là 2.3 = 6 electron
b) Phân lớp d có 5 AO
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp d là 2.5 = 10 electron
c) Lớp K (n = 1) có 12 = 1 AO.
⇒ Số electron tối đa trong lớp K là 2.1 = 2 electron.
d) Lớp M (n = 3) có 32 = 9 AO
⇒ Số electron tối đa trong lớp M là 2.9 = 18 electron.
Vận dụng
Bài 3.23 trang 10 SBT Hóa học 10: Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17.
Viết cấu hình electron nguyên tử của nguyên tố X và Y. Khi nguyên tử của nguyên tố X nhường đi hai electron và nguyên tử của nguyên tố Y nhận thêm một electron thì lớp electron ngoài cùng của chúng có đặc điểm gì?
Lời giải:
– Nguyên tử X (Z = 12) có cấu hình electron: 1s22s22p63s2
X nhường đi 2 electron: X → X2+ + 2e
Cấu hình electron của ion X2+ là 1s22s22p6
- Nguyên tử Y (Z = 17) có cấu hình electron: 1s22s22p63s23p5
Y nhận thêm 1 electron: Y + e → Y-
Cấu hình electron của Y- là 1s22s22p63s23p6
- Cấu hình electron của ion X2+ giống khí hiếm Ne, có 8 electron lớp ngoài cùng.
- Cấu hình electron của ion Y- giống với cấu hình electron của khí hiếm Ar, có 8 electron lớp ngoài cùng.
Lời giải:
+) Z = 9 (1s22s22p5): nguyên tử có 7 electron hóa trị, dễ thu electron, là phi kim.
Cấu hình electron theo ô orbital:
+) Z = 14 (1s22s22p63s23p2): nguyên tử có 4 electron hóa trị nên có thể thu electron hoặc nhường electron, là phi kim.
Cấu hình electron theo ô orbital:
+) Z = 21 (1s22s22p63s23p63d14s2): nguyên tử có 3 electron hóa trị, dễ nhường electron, là kim loại.
a) Xác định công thức hóa học của A.
b) Viết cấu hình electron của các nguyên tử tạo nên A.
Lời giải:
a) Coi tổng số hạt trong [M] là x và [X] là y
Theo bài ra ta có: 4x + 3y = 214 (I)
và 4x – 3y = 106 (II)
Giải hệ (I) và (II), ta được: x = 40 và y = 18.
Số p = số e nên ta có:
2pM + nM = 40 với và pM < 20
⇒ pM = 13 và nM = 14
⇒ M là 13Al.
2pX + nX = 18 với và pX < 9
⇒ pX = 6 và nX = 6
⇒ X là 6C.
Công thức hóa học của A là Al4C3.
b) Cấu hình electron: 13Al (1s22s22p63s23p1) và 6C (1s22s22p2)
Bài giảng Hóa học 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử - Kết nối tri thức
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Lý thuyết Cấu trúc lớp vỏ electron nguyên tử
I. Chuyển động của electron trong nguyên tử
Đầu thế kỉ XX, người ta vẫn cho rằng các electron chuyển động xung quanh hạt nhân nguyên tử theo những quỹ đạo tròn hay bầu dục, giống như quỹ đạo của các hành tinh quay xung quanh Mặt Trời.
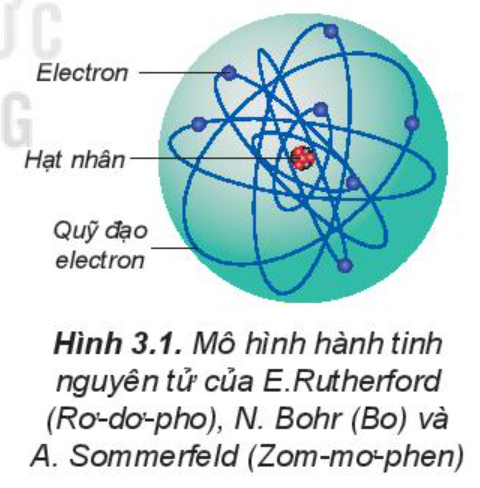
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Vùng không gian xung quanh hạt nhân có xác suất tìm thấy electron là lớn nhất (khoảng 90%) và có thể hình dung vùng không gian đó như một đám mây electron, được gọi là orbital nguyên tử (kí hiệu là AO).

1. Hình dạng orbital nguyên tử
Dựa trên sự khác nhau về hình dạng, sự định hướng của orbital trong nguyên tử để phân loại orbital thành orbital s, orbital p, orbital d và orbital f. Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.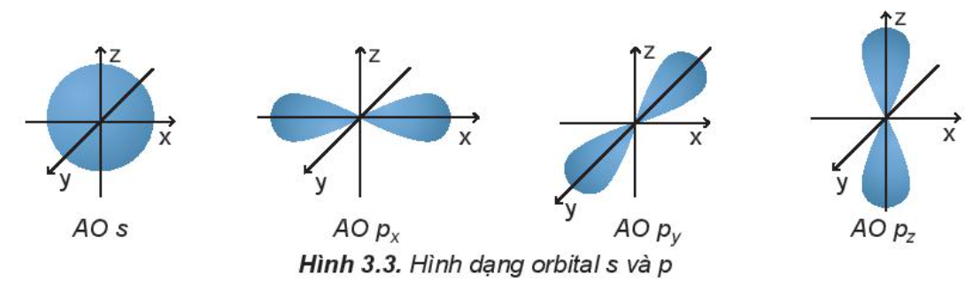
2. Ô orbital
Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital .
Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau. Nếu orbital có 1 electron thì biểu diễn bằng một mũi tên đi lên (), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước ().
II. Lớp và phân lớp electron
Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo các mức năng lượng từ thấp đến cao.
1. Lớp electron
Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân.
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Số thứ tự lớp từ trong ra ngoài và được biểu thị bằng các số nguyên n = 1, 2, 3, …, 7 với tên gọi là các chữ cái in hoa như sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
2. Phân lớp electron
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái thường, theo thứ tự: s, p, d, f.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4):
Lớp thứ nhất (lớp K, với n = 1) có một phân lớp, được kí hiệu là 1s.
Lớp thứ hai (lớp L, với n = 2) có hai phân lớp, được kí hiệu là 2s và 2p.
Lớp thứ ba (lớp M, với n = 3) có ba phân lớp, được kí hiệu là 3s, 3p và 3d.
Lớp thứ tư (lớp N, với n = 4) có bốn phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Các electron ở phân lớp s gọi là electron s, các electron ở phân lớp p gọi là electron p, …
3. Số lượng orbital trong một phân lớp, trong một lớp
Trong một phân lớp, các orital có cùng mức năng lượng.
- Phân lớp s có 1 AO s:
|
|
- Phân lớp p có 3 AO px, py, pz:
|
|
|
|
- Phân lớp d có 5 AO:
|
|
|
|
|
|
- Phân lớp f có 7 AO:
|
|
|
|
|
|
|
|
Trong lớp electron thứ n có n2 AO (n ≤ 4).
Ví dụ 1: Lớp L (n = 2) có 2 phân lớp 2s và 2p.
Trong đó, phân lớp 2s có 1 AO, phân lớp 2p có 3 AO nên tổng số orbital trong lớp L là:
1 + 3 = 4 hay 22 AO.
Ví dụ 2: Cho biết tổng số electron tối đa trong các phân lớp s, p, d và f.
Hướng dẫn:
Trong 1 orbital chỉ chứa tối đa 2 electron.
Phân lớp s có 1 AO Số electron tối đa trong phân lớp s là: 1×2 = 2.
Phân lớp p có 3 AO Số electron tối đa trong phân lớp p là: 3×2 = 6.
Phân lớp d có 5 AO Số electron tối đa trong phân lớp d là: 5×2 = 10.
Phân lớp f có 7 AO Số electron tối đa trong phân lớp f là: 7×2 = 14.
Ví dụ 3: Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tính tổng số electron tối đa trong mỗi lớp L và M.
Hướng dẫn:
Lớp L (n = 2) có hai phân lớp 2s và 2p, có n2 = 22 = 4 AO.
Tổng số electron tối đa trong lớp L là: 4×2 = 8 (electron).
Lớp M (n = 3) có ba phân lớp 3s, 3p và 3d, có n2 = 32 = 9 AO.
Tổng số electron tối đa trong lớp M là: 9×2 = 18 (electron).
III. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Cấu hình electron của nguyên tử cho biết số lớp electron, thứ tự phân lớp electron và số electron trong mỗi lớp và mỗi phân lớp.
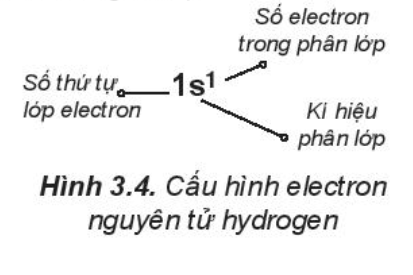
1. Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s 2s 2p 3s 3p 4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
Ví dụ 1: Viết cấu hình electron của nguyên tử nitrogen (Z = 7).
- Tổng số electron của nguyên tử N là 7.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p3.
- Có thể thay 1s2 bằng kí hiệu [He]. Cấu hình electron của nguyên tử N là 1s22s22p3 hoặc [He]2s22p3 hoặc (2, 5).
Electron cuối cùng điền vào phân lớp p nên nitrogen là nguyên tố p.
Ví dụ 2: Viết cấu hình electron của nguyên tử potassium (Z = 19).
- Tổng số electron của nguyên tử K là 19.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p63s23p64s1.
- Có thể thay 1s22s22p63s23p6 bằng kí hiệu [Ar]. Cấu hình electron của nguyên tử K là 1s22s22p63s23p64s1 hoặc [Ar]4s1 hoặc (2, 8, 8, 1).
Electron cuối cùng điền vào phân lớp s nên potassium là nguyên tố s.
2. Biểu diễn cấu hình electron theo ô orbital
Ví dụ: Cấu hình electron của nguyên tử nitrogen có Z = 7: 1s22s22p5 có thể được biểu diễn theo ô orbital như sau:
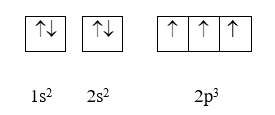
Hai ô orbital 1s và 2s có đủ 2 electron được biểu diễn bằng hai mũi tên ngược chiều nhau (nguyên lí Pauli). 3 electron còn lại được sắp xếp vào 3 orbital 2p bằng 3 mũi tên đi lên để số electron độc thân là tối đa (quy tắc Hund).
3. Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
- Các nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim.
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
Ví dụ: Nguyên tử nguyên tố X có Z = 17.
Cấu hình electron của nguyên tử X là: 1s22s22p63s23p5 hoặc [Ne]3s23p5.
Nguyên tử nguyên tố X có 7 electron lớp ngoài cùng X là nguyên tố phi kim.