Với tóm tắt lý thuyết Hóa học lớp 11 Bài 7: Sulfur và sulfur dioxide sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 7: Sulfur và sulfur dioxide
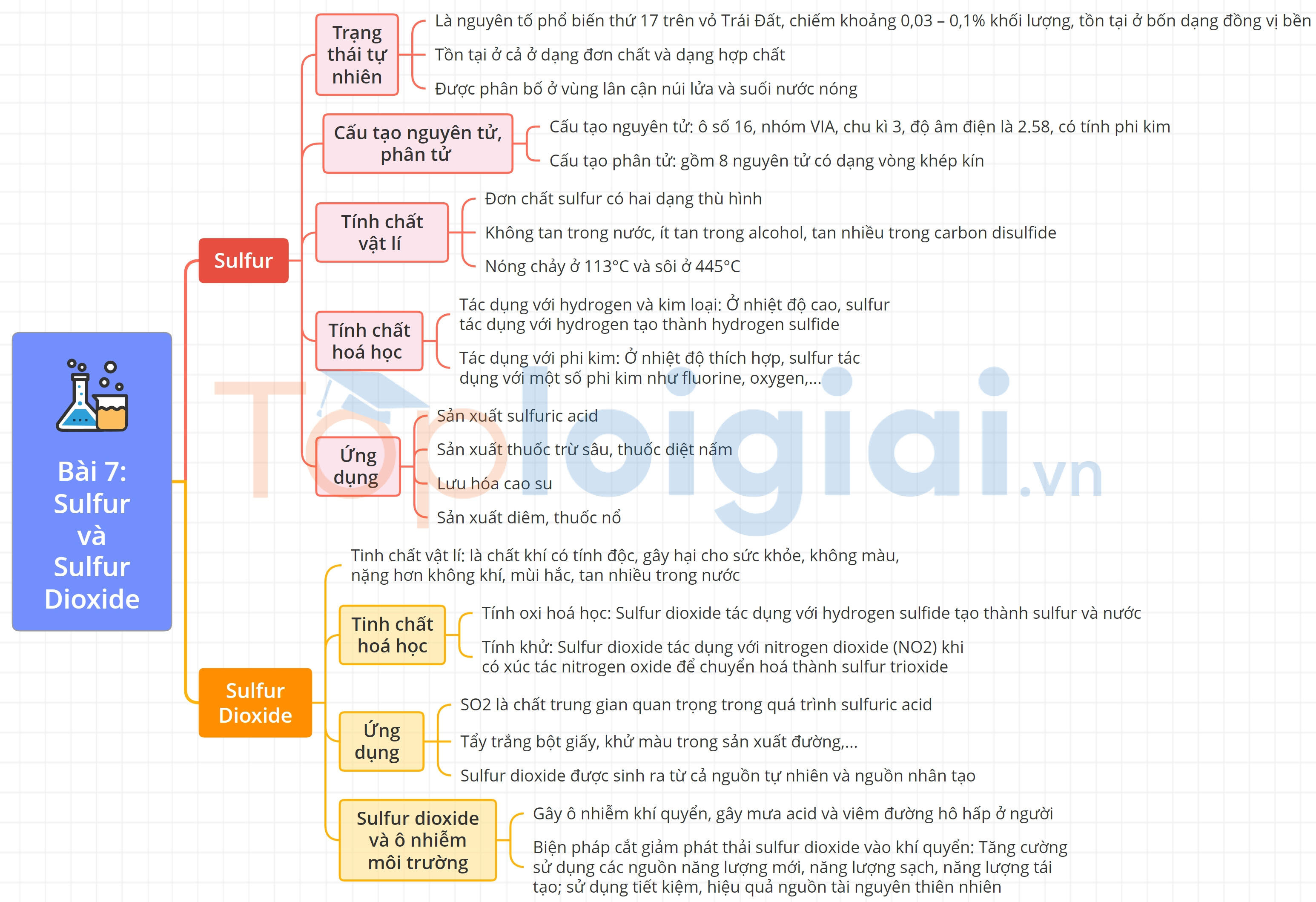
A. Lý thuyết Sulfur và sulfur dioxide
I. Sulfur
1. Trạng thái tự nhiên
- Là nguyên tố phổ biến thứ 17 trên vỏ TĐ.
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
2. Cấu tạo nguyên tử, phân tử
a, Cấu tạo nguyên tử
- Vị trí trong BTH:
+ Ô: 16.
+ Chu kì: 3.
+ Nhóm: VIA.
- Sulfur có tính phi kim.
- Số oxi hóa: -2, 0, +4, +6.
b, Cấu tạo phân tử
Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín.
Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết CHT không phân cực.
3. Tính chất vật lí
- Có hai dạng thù hình: dạng tà phương và dạng đơn tà.
- Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide.
4. Tính chất hóa học
a, Tác dụng với hydrogen và kim loại
- Tác dụng với hydrogen
S(s) +H2(g) H2S(g)
- Tác dụng với kim loại tạo ra muối sulfide
Hg + S → HgS
2Al + 3S → Al2S3
b, Tác dụng với phi kim
S + 3F2 → SF6
S + O2 → SO2
5. Ứng dụng
- Lưu hóa cao su.
- Sản xuất sulfuric acid.
- Sản xuất thuốc trừ sâu, thuốc diệt nấm.
II. Sulfur dioxide
1. Tính chất vật lí
- SO2 là chất khí không màu, năng hơn không khí, mùi hắc, tan nhiều trong nước.
- SO2 là khí độc.
2. Tính chất hóa học
a, Tính oxi hóa
- Tác dụng với hydrogen sulfide: SO2 + 2H2S → 3S + 2H2O
b, Tính khử
- Tác dụng với nitrogen dioxide (NO2): SO2 + NO2 →SO3 + NO
3. Ứng dụng
- Là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Tẩy trắng và diệt khuẩn.
- Là dung môi để thực hiện nhiều phản ứng.
4. Sulfur dioxide và ô nhiễm môi trường
a, Nguồn phát sinh
- Tự nhiên: khí thải núi lửa …
- Nhân tạo: đốt cháy nhiên liệu, quặng sulfide, luyện kim ….
b, Tác hại
- Gây ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người.
c, Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo.
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Sơ đồ tư duy Sulfur và sulfur dioxide
B. Trắc nghiệm Sulfur và sulfur dioxide
Câu 1: Dãy chất nào sau đây đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. Dung dịch BaCl2, CaO, nước bromine.
B. Dung dịch NaOH, O2, dung dịch KMnO4.
C. O2, nước bromine, dung dịch KMnO4.
D. H2S, O2, nước bromine.
Đáp án đúng là: C
Dãy chất thể hiện tính oxi hóa khi phản ứng với SO2 là O2, nước bromine, dung dịch KMnO4.
Câu 2: Khí nào sau đây có khả năng làm mất màu nước bromine?
A. N2.
B. CO2.
C. H2.
D. SO2.
Đáp án đúng là: D
Khí SO2 có khả năng làm mất màu nước bromine.
Câu 3: Sulfur dioxide có thể tham gia những phản ứng sau:
(1) SO2 + Br2 + 2H2O H2SO4 + 2HBr
(2) SO2 + 2H2S 3S + 2H2O
Câu nào sau đây diễn tả không đúng tính chất của các chất trong phản ứng trên?
A. Phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (2): SO2 là vừa là chất khử, vừa là chất oxi hóa.
A. Phản ứng (1): Br2 là chất oxi hóa; phản ứng (2): H2S là chất khử.
Đáp án đúng là: C
Vì phản ứng (2): SO2 là chất oxi hóa.
Câu 4: Cho các phản ứng:
(1) SO2 + Br2 + 2H2O →
(2) 2SO2 + O2
(3) 5SO2 + 2KMnO4 + 2H2O →
(4) SO2 + 2NaOH →
(5) SO2 + 2H2S →
(6) SO2 + 2Mg →
Tính oxi hóa của SO2 được thể hiện ở phản ứng nào?
A. 1, 2, 3.
B. 1, 2, 3, 5.
C. 1, 2, 3, 5, 6.
D. 5, 6.
Đáp án đúng là: D
Tính oxi hóa của SO2 được thể hiện ở phản ứng (5), (6)
Câu 5: Cho các phản ứng:
(1) SO2 + Cl2 + 2H2O → H2SO4 + 2HCl
(2) SO2 + 2Mg → S + 2MgO
(3) SO2 + 2H2S → 3S + 2H2O
(4) 2SO2 + O2 → 2SO3
(5) SO2 + NaOH → NaHSO3
(6) SO2 + 2NaOH → Na2SO3 + H2O
(7) 5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
Những phản ứng mà SO2 thể hiện tính khử là
A. (1); (2); (4); (5).
B. (2); (3); (6); (7).
C. (1); (4); (7).
D. (1); (7).
Đáp án đúng là: C
Những phản ứng mà SO2 thể hiện tính khử là (1); (4); (7).
Câu 6: Tính chất nào sau đây không phải tính chất vật lí của sulfur?
A. Màu vàng ở điều kiện thường.
B. Thể rắn ở điều kiện thường.
C. Không tan trong benzene.
D. Không tan trong nước.
Đáp án đúng là: C
Tính chất vật lí của sulfur: Ở điều kiện thường, sulfur có màu vàng, ở thể rắn, không tan trong nước, ít tan trong alcohol,…
Câu 7: Cho các phản ứng sau:
(a) S + O2 SO2
(b) Hg + S HgS
(c) S + 6HNO3 H2SO4 + 6NO2 + 2H2O
(d) Fe + S FeS
Có bao nhiêu phản ứng trong đó sulfur đóng vai trò là chất khử?
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: B
Sulfur đóng vai trò là chất khử trong phản ứng (a), (c).
Câu 8: Sulfur dioxide có tính chất hóa học gì?
A. có tính khử mạnh.
B. có tính oxi hoá yếu.
C. có tính oxi hoá mạnh.
D. vừa có tính khử và vừa có tính oxi hoá.
Đáp án đúng là: D
Sulfur dioxide vừa có tính khử và vừa có tính oxi hoá.
Câu 9: Sulfur trong chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. H2S.
B. Na2SO4.
C. SO2.
D. H2SO4.
Đáp án đúng là: C
Sulfur dioxide vừa có tính khử và vừa có tính oxi hoá.
Câu 10: SO2 luôn thể hiện tính khử trong các phản ứng với
A. H2S, O2, nước Br2.
B. dung dịch NaOH, O2, dung dịch KMnO4.
C. dung dịch KOH, CaO, nước Br2.
D. O2, nước Br2, dung dịch KMnO4.
Đáp án đúng là: D
SO2 luôn thể hiện tính khử trong các phản ứng vớiO2, nước Br2, dung dịch KMnO4.
Câu 11: Chất được dùng để tẩy trắng giấy và bột giấy trong công nghiệp là
A. N2O.
B. CO2.
C. SO2.
D. NO2.
Đáp án đúng là: C
SO2 dùng để tẩy trắng giấy và bột giấy trong công nghiệp.
Câu 12: SO2 là một khí độc được thải ra từ các vùng công nghiệp, là một trong những nguyên nhân chính gây ra hiện tượng nào dưới đây?
A. Mưa acid.
B. Hiệu ứng nhà kính.
C. Hiệu ứng đomino.
D. Sương mù.
Đáp án đúng là: A
SO2 là một khí độc được thải ra từ các vùng công nghiệp, là một trong những nguyên nhân chính gây ra hiện tượng mưa acid.
Câu 13: Cho các phát biểu sau:
(a) Sulfur là chất rắn, màu trắng, không tan trong nước.
(b) Sulfur và sulfur dioxide vừa có tính oxi hóa, vừa có tính khử.
(c) Khi phản ứng với hydrogen, sulfur thể hiện tính oxi hóa
(d) Nước thải sinh hoạt là một trong các nguồn phát thải khí SO2.
(e) Sulfur dioxide được sử dụng để tẩy trắng vải sợi, bột giấy, sản xuất sulfuric acid và diệt nấm mốc.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: C
Phát biểu đúng là (b), (c), (e)
(a) sai vì sulfur là chất rắn màu vàng.
(d) sai vì khí thải trong sinh hoạt (đốt cháy các nhiên liệu hoá thạch như than) mới thải khí SO2.
Câu 14: Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là
A. nước bromine.
B. CaO.
C. dung dịch Ba(OH)2.
D. dung dịch NaOH.
Đáp án đúng là: A
Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là nước bromine. Vì chỉ có SO2 mới phản ứng với nước bromine, còn CO2 thì không.
Câu 15: Cho các phản ứng sinh ra khí SO2:
(1) 4FeS2 + 11O2 2Fe2O3 + 8SO2
(2) S + O2 SO2
(3) Cu + 2H2SO4 CuSO4 + SO2 + 2H2O
(4) Na2SO3 + H2SO4 Na2SO4 + SO2 + H2O
Các phản ứng được dùng để điều chế khí SO2 trong công nghiệp là
A. (1) và (2).
B. (2) và (3).
C. (2) và (4).
D. (1), (2) và (3).
Đáp án đúng là: A
Các phản ứng được dùng để điều chế khí SO2 trong công nghiệp là:(1) và (2).
Xem thêm các bài tóm tắt Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 6: Một số hợp chất của nitrogen với oxygen
Lý thuyết Bài 7: Sulfur và sulfur dioxide
Lý thuyết Bài 8: Sulfuric acid và muối sulfate
Lý thuyết Bài 10: Hợp chất hữu cơ và hoá học hữu cơ
Lý thuyết Bài 11: Phương pháp tách biệt và tinh chế hợp chất hữu cơ