Tailieumoi.vn biên soạn và giới thiệu các kiến thức trọng tâm về Magie (Mg) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Magie (Mg), giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Magie (Mg): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Magie là nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Mg và số nguyên tử bằng 12. Magiê là nguyên tố phổ biến thứ 8 trong vỏ Trái Đất.
- Kí hiệu: Mg
- Cấu hình electron: [Ne] 3s2
- Số hiệu nguyên tử: 12
- Khối lượng nguyên tử: 24 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 12
+ Nhóm: IIA
+ Chu kì: 3
- Đồng vị: 24Mg, 25Mg, 26Mg
- Độ âm điện: 1,31
1. Tính chất vật lí:
- Magiê là kim loại tương đối cứng, màu trắng bạc, nhẹ.
- Mg có khối lượng riêng là 1,737 (g/cm3); có nhiệt độ nóng chảy là 6480C và sôi ở 10950C.
2. Nhận biết
- Đốt cháy các hợp chất của Canxi, cho ngọn lửa màu da cam.
- Magie là chất khử mạnh:
Mg → Mg2+ + 2e
a. Tác dụng với phi kim
Lưu ý:
- Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
c. Tác dụng với nước
- Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng (do tạo thành hidroxit khó tan).
Mg + 2H2O → Mg(OH)2 + H2
- 24Mg là đồng vị ổn định có ứng dụng trong địa chất học, tương tự như 26Al. 24Mg là sản phẩm phân rã của 26Al, có chu kỳ bán rã 717.000 năm.
- Magiê được tìm thấy trong hơn 60 khoáng chất, nhưng chỉ có đôlômit, magnesit, bruxit, cacnalit, bột tan, và ôlivin là có giá trị thương mại.
- Điện phân nóng chảy muối magie clorua.
- Các hợp chất của magiê, chủ yếu là oxit magiê, được sử dụng như là vật liệu chịu lửa trong các lò sản xuất sắt và thép, các kim loại màu, thủy tinh hay xi măng.
- Hợp kim nhôm - magiê dùng trong sản xuất vỏ đồ hộp, cũng như trong các thành phần cấu trúc của ô tô và máy móc. Ngoài ra magiê kim loại còn được sử dụng để khử lưu huỳnh từ sắt hay thép.
VIII. Bài tập liên quan về Magie (Mg)
Ví dụ 1: Cho Mg tác dụng với dung dịch axit photphoric thu được muối phôtphat và 3,36 lít khí H2 (đktc). Khối lượng muối thu được sau phản ứng:
A. 13,1 g B. 2,63g C. 26,3 g D. 5,12 g
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng: 3Mg + 2H3PO4 → Mg3(PO4)2 + 3H2
nmuối = 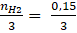
Ví dụ 2: Cho 2,4 g Mg tác dụng với H3PO4 dư thu được V lít khí H2. Giá trị của V là:
A. 11,2 lít B. 2,24 lít C. 5,6 lít D. 3,36 lít
Hướng dẫn giải:
Đáp án B
Phương trình phản ứng: 3Mg + 2H3PO4 → Mg3(PO4)2 + 3H2
nH2 = nMg = 0,1 mol ⇒ V = 0,1.22,4 = 2,24 lít
Ví dụ 3: Cho Mg tác dụng với các chất sau: K, HCl, H3PO4, AgNO3, Cu. Số phản ứng không xảy ra là:
A. 1 B. 2 C. 3 D. 4
Hướng dẫn giải:
Đáp án B
K và Cu không tham gia phản ứng với Mg
Ví dụ 4: Cho dãy các kim loại: Na, Ba, Al, K, Mg. Số kim loại trong dãy phản ứng với lượng dư dung dịch FeCl3 thu được kết tủa là:
A. 5 B. 3 C. 2 D. 4
Hướng dẫn giải:
Đáp án B
6Na + 2FeCl3 + 6H2O → 6NaCl + 2Fe(OH)3 + 3H2
6K + 2FeCl3 + 6H2O → 6KCl + 2Fe(OH)3 + 3H2
3Ba + 2FeCl3 + 6H2O → 3BaCl2 + 2Fe(OH)3 + 3H2
Ví dụ 5: Khi cho Mg tác dụng với dung dịch sắt(III)clorua dư. Phản ứng xảy ra là:
A. 3Mg + 2FeCl3 → 2Fe + 3MgCl2
B. Mg + 2FeCl3 → MgCl2 + 2FeCl2
B. Mg + 2FeCl3 → MgCl2 + 2FeCl2
D. Không xảy ra phản ứng
Hướng dẫn giải:
Đáp án B
Ví dụ 6: Cho 2,4 g Mg tác dụng vừa đủ với dung dịch sắt(III)clorua thu được 2 muối . Khối lượng muối thu được sau phản ứng là:
A. 9,5 g B. 25,4 g B. 34,9 g D. 36,6 g
Hướng dẫn giải:
Đáp án B
Mg + 2FeCl3 → MgCl2 + 2FeCl2
nMgCl2 = nMg = 0,1 mol ; nFeCl2 = 2nMg = 0,2 mol
mmuối = mMgCl2 + mFeCl2 = 95.0,1 + 127.0,2 = 34,9 g