Bài viết về tính chất hóa học của kim loại gồm đầy đủ thông tin về tính chất vật lí, tính chất hóa học, cách điều chế, .... Mời các bạn đón xem:
Tính chất hóa học của Kim loại
• Tính dẻo
- Kim loại có tính dẻo.
- Các kim loại khác nhau có tính dẻo khác nhau.Do có tính dẻo nên kim loại được rèn, kéo sợi, dát mỏng tạo nên các đồ vật khác nhau.
• Tính dẫn điện
- Kim loại có tính dẫn điện.
- Các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại có khả năng dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,...Do có tính dẫn điện, một số kim loại được sử dụng làm dây dẫn điện. Thí dụ như: đồng, nhôm, ...
- Chú ý: Không nên sử dụng dây dẫn điện trần hoặc dây điện đã bị hỏng lớp bọc cách điện để tránh bị điện giật, hay cháy do chập điện,...
• Tính dẫn nhiệt
- Kim loại có tính dẫn nhiệt .
- Kim loại khác nhau có tính dẫn nhiệt khác nhau. Kim loại nào dẫn điện tốt cũng thường dẫn nhiệt tốt.
- Dó có tính dẫn nhiệt và một số tính chất khác, nhôm, thép không gỉ (inox) được dùng để làm dụng cụ nấu ăn.
• Ánh kim
- Kim loại có ánh kim.Nhờ tính chất này, một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác.
II. Tính chất hóa học của Kim loại
• Phản ứng của kim loại với phi kim
1 Tác dụng với oxi
- Khi đốt nóng đỏ, sắt cháy trong oxi tạo thành oxit sắt từ
- Nhiều phi kim khác như Al, Zn, Cu... phản ứng với oxi tạo thành các oxit Al2O3, ZnO, CuO...
2 Tác dụng với phi kim khác
- Natri nóng chảy cháy trong khí clo tạo thành khói trắng.
- Ở nhiệt độ cao, đồng, magie, sắt... phản ứng với lưu huỳnh cho sản phẩm là các muối sunfua CuS, MgS, FeS,...
- Hầu hết kim loại (trừ Ag, Au, Pt...) phản ứng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit (thường là oxit bazơ). Ở nhiệt độ cao kim loại phản ứng với nhiều phi kim khác tạo thành muối.
• Phản ứng của kim loại với dung dịch axit
- Một số kim loại phản ứng với dung dịch axit (H2SO4 loãng, HCl...) tạo thành muối và giải phóng khí hiđro.
Zn(r)+H2SO4(dd)→ZnSO4 (dd)+ H2(k)
• Phản ứng của kim loại với dung dịch muối
- Phản ứng của đồng với dung dịch bạc nitrat
Cu (r)+ 2AgNO3 (dd)→ Cu(NO3)2 (dd) + 2Ag (r)
Đồng đã đẩy bạc ra khỏi muối. Ta nói đồng hoạt động hóa học mạnh hơn bạc.
- Phản ứng của kẽm với dung dịch đồng (II) sunfat
Kẽm đẩy đồng ra khỏi dung dịch CuSO4.
Zn (r) + CuSO4 (dd) → ZnSO4 (dd) + Cu (r)
Ta nói kẽm hoạt động hóa học mạnh hơn đồng.
- Phản ứng của kim loại Mg, Al, Zn, ... với dung dịch CuSO4 hay AgNO3 tạo thành muối magie, muối nhôm, muối kẽm, ... và kim loại Cu và Ag được giải phóng.
Ta nói: Al, Zn, Mg hoạt động hóa học mạnh hơn Cu, Ag.
=>Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Ca ...) có thể đẩy kim loại hoạt động hóa học yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
III. Điều chế Kim loại
Nguyên tắc điều chế kim loại
- Trong tự nhiên chỉ có một số ít kim loại ở trạng thái tự do, hầu hết các kim loại đều tồn tại dưới dạng ion trong các hợp chất hóa họ. Muốn chuyển hóa những ion này thành kim loại ta thực hiện quá trình khử ion kim loại:
Mn+ + ne → M
- Có 3 phương pháp điều chế kim loại.
1) Phương pháp thủy luyện
- Phương pháp thủy luyện (còn gọi là phương pháp ướt) được dùng điều chế những kim loại có tính khử yếu, như Cu, Hg, Ag, Au,...
2) Phương pháp nhiệt luyện
- Phương pháp nhiệt luyện được ứng dụng rộng rãi trong công nghiệp dùng để điều chế những kim loại có độ hoạt động hóa học trung bình như Zn, Fe, Sn, Pb,...
- Với những kim loại kém hoạt động như Hg, Ag chỉ cần đốt cháy quặng cũng đã thu được kim loại mà không cần thiết phải khử bằng các tác nhân khác:
3) Phương pháp điện phân
- Điều chế kim loại có tính khử mạnh như Li, Na, K, Al, ... bằng cách điện phân các hợp chất ( muối, bazơ, oxit) nóng chảy của chúng.
- Thí dụ: Điều chế kim loại kẽm bằng phương pháp điện phân dung dịch kẽm sunfat với điện cực trơ.
Phương trình điện phân:
IV. Ứng dụng của kim loại
Kim loại phổ biến như vậy nên hầu hết các ngành nghề khác nhau đều sử dụng loại vật liệu này.
1. Trong xây dựng
Kim loại đen, kim loại cơ bản thường được dùng cho các công trình xây dựng như nhà ở. tòa nhà cao tầng, cầu đường và hầu hết các kiến trúc khác.
2. Trong gia dụng
Kim loại được sử dụng để tạo ra các sản phẩm phục vụ đời sống như bàn ghế, dụng cụ bếp, cầu thang,...
3 Trong sản xuất
Trong nhiều ngành nghề khác nhau có thể dùng kim loại để sản xuất ra các máy móc, thiết bị. Chúng thường tạo ra nhiều chi tiết, phụ kiện, chế tạo phôi, khuôn đúc,...
4. Trong giao thông vận tải
Kim loại được ứng dụng làm vỏ các loại phương tiện, chi tiết máy móc, phụ kiện, khớp nối,... Trong các phương tiện đi lại hàng ngày đều có sử dụng kim loại như xe đạp, xe máy, ô tô, tàu thủy, máy bay,...
5. Trong hóa học
Ngoài các ứng dụng phổ biến trên, kim loại còn được dùng để nghiên cứu, phân tích các phản ứng hóa học. Từ đó, các nhà khoa học phát triển thêm nhiều vật liệu hữu ích khác trên các nền tảng là các nguyên tố kim loại cơ bản nhằm phục vụ cho cuộc sống hiện đại.

V. Bài tập liên quan về kim loại
Dạng 1: Xác định một kim loại dựa vào phản ứng
a) Phương pháp giải
Bước 1: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
– Công thức bảo toàn electron:
nhường = nhận
– Công thức bảo toàn nguyên tố: Giả sử ta có hợp chất AxBy
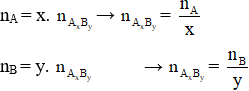
Chú ý:
Bước 2: Tính nguyên tử khối theo công thức (g/mol), từ đó suy ra tên kim loại
b) Ví dụ minh họa
Ví dụ 1: Hòa tan hết 4,68 gam kim loại kiềm M vào nước dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là
A. Rb.
B. Li.
C. K.
D. Na.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
(g/mol)
Vậy M là kim loại kali (K)
Chọn C.
Ví dụ 2: Cho 4,017 gam một kim loại kiềm X hòa tan vào nước dư được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 0,103 mol HCl. Kim loại X là
A. Na.
B. Li.
C. Rb.
D. K.
Lời giải chi tiết
Phương trình hóa học:
2X + 2H2O 2XOH + H2(1)
XOH + HCl XCl + H2O (2)
Theo phương trình (2): nXOH = nHCl = 0,103 mol
Theo phương trình (1): nX = nXOH = 0,103 mol
(g/mol)
Vậy X là kim loại kali (K)
Chọn D.
Dạng 2: Xác định hai kim loại liên tiếp trong một nhóm bằng phương pháp trung bình
a) Phương pháp giải
Bước 1: Đặt công thức chung của hai kim loại là R.
Bước 2: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
– Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
Bước 3: Tính phân tử khối trung bình theo công thức , từ đó kết hợp với điều kiện của bài toán suy ra tên kim loại.
– Nếu dung dịch bazơ tạo thành sau khi phản ứng với nước được trung hòa bởi H+ thì ta có:
– Nếu dung dịch bazơ tạo thành sau khi phản ứng với nước kết tủa với các cation kim loại thì viết phương trình ion và tính.
b) Ví dụ minh họa
Ví dụ 1: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng nhóm IA. Lấy 6,2 gam X hòa tan hoàn toàn vào nước thu được 2,24 lít hiđro (đktc). A, B là
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Lời giải chi tiết
Đặt công thức chung của A và B là M
Phương trình phản ứng:
2M + 2H2O 2MOH + H2(1)
Theo phương trình:
Vậy hai kim loại là Na và K
Chọn B.
Ví dụ 2: A là hỗn hợp hai kim loại kiềm X và Y thuộc hai chu kì kế tiếp. Nếu cho A tác dụng vừa đủ với dung dịch HCl thì thu được a gam hai muối, còn nếu cho A tác dụng vừa đủ với dung dịch H2SO4 thì thu được 1,1807a gam hai muối. X và Y là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Lời giải chi tiết
Đặt công thức chung của hai kim loại kiềm là R, khối lượng mol trung bình của chúng là
Chọn số mol của R tham gia phản ứng là 1 mol
Phương trình phản ứng:
2R + 2HCl 2RCl + H2 (1)
2R + H2SO4 R2SO4 + H2 (2)
Theo phương trình (1):
(3)
Theo phương trình (2):
(4)
Từ (3) và (4) ta có
Nhận xét:
X và Y là Na và K
Chọn B.