Với tóm tắt lý thuyết Hóa học lớp 11 Bài 2: Cân bằng trong dung dịch nước sách Chân trời sáng tạo hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 2: Cân bằng trong dung dịch nước
A. Lý thuyết Cân bằng trong dung dịch nước
1. Sự điện li, chất điện li, chất không điện li
a. Tìm hiểu hiện tượng điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành các ion.
Ví dụ:
NaCl → Na+ + Cl-
NaOH → Na+ + OH-
HCl → H+ + Cl-
b. Tìm hiểu sự phân loại các chất điện li
- Chất điện li mạnh: Là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion
Ví dụ: Axit HCl, HNO3, Bazo mạnh (NaOH, KOH),…
- Chất điện li yếu: Là chất khi tan trong nước, chỉ có một số phân tự hòa tan thành ion, còn lại vẫn tồn tạo ở dạng phân tử
Ví dụ: Axit hữu cơ CH3COOH, axit HClO, H2S, HE,…
- Chất không điện li: Là chất khi hòa tan trong nước, các phân tử không phân li thành ion.
2. Thuyết Brønsted–Lowry về acid–base
- Acid là chất proton (H+)
- Base là chất nhận proton
=> Acid và base có thể là phân tử hoặc ion
CH3COOH + H2O ⇌ CH3COO– + H3O+
3. Khái niệm pH chất chỉ thị Acid - base
a. Tìm hiểu khái niệm pH
- pH là chỉ số đánh giá độ acid hay base của một dung dịch
- Thang pH thường dùng có giá trị từ 1 đến 14
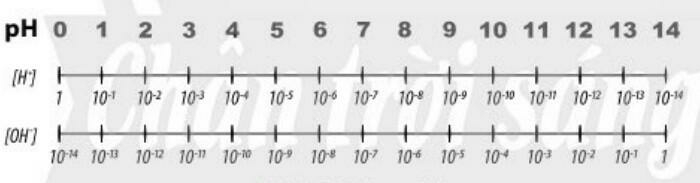
b. Tìm hiểu ý nghĩa của pH trong thực tiễn
- Chất chỉ thị acid - base là chất có màu sắc biến đổi theo giái trị pH của dung dịch

4. Chuẩn độ Acid - Base
- Để xác định nồng độ dung dịch acid hoặc base chưa biết người ta dùng dung dịch acid hoặc base (kiềm) đã biết chính xác nồng độ.
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO32-
a. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
- Ion Al3+, Fe3+, dễ bị phân hủy trong nước tạo thành base không tan và cho môi trường acid.
b. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
CO32- +H2O ⇌ HCO3- + HO-
- Ion CO32- bị phân hủy cho môi trường base
Sơ đồ tư duy Cân bằng trong dung dịch nước
B. Trắc nghiệm Cân bằng trong dung dịch nước
Câu 1. Trong dung dịch acetic acid (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, CH3COO−.
B. H+, CH3COO−, H2O.
C. CH3COOH, H+, CH3COO−, H2O.
D. CH3COOH, CH3COO−, H+.
Đáp án đúng là: D
CH3COOH là chất điện li yếu.
Trong dung dịch acetic acid (bỏ qua sự phân li của H2O) có những phần tử: CH3COOH, H+, CH3COO−, H2O.
Câu 2. Cho phương trình:
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH3COOH.
B. H2O.
C. CH3COO−.
D. H3O+.
Đáp án đúng là: A
Trong phản ứng thuận, CH3COOH là acid do nhường H+.
Câu 3. Trong phản ứng sau đây:
Những chất nào đóng vai trò là base theo thuyết Bronsted – Lowry?
A.
B.
C. H2O và OH−.
D.
Đáp án đúng là: A
Trong phản ứng thuận, là base; trong phản ứng nghịch OH− là base.
Câu 4. Saccharose là chất không điện li vì:
A. Phân tử saccharose không có khả năng hòa tan trong nước.
B. Phân tử saccharose không có khả năng phân li thành ion trong nước.
C. Phân tử saccharose không có tính dẫn điện.
D. Phân tử saccharose có khả năng hòa tan trong nước.
Đáp án đúng là: B
Saccharose là chất không điện li vì phân tử saccharose không có khả năng phân li thành ion trong nước.
Câu 5. Hãy cho biết tập hợp các chất nào sau đây đều là chất điện li yếu?
A. Cu(OH)2, NaCl, C2H5OH, HCl.
B. C6H12O6, Na2SO4, NaNO3, H2SO4.
C. NaOH, NaCl, Na2SO4, HNO3.
D. CH3COOH, HF, Mg(OH)2, H2S.
Đáp án đúng là: D
Acid yếu, base yếu là các chất điện li yếu.
Vậy CH3COOH, HF, Mg(OH)2, H2S là các chất điện li yếu.
Câu 6. Chất nào sau đây là chất điện li?
A. Cl2.
B. HNO3.
C. MgO.
D. CH4.
Đáp án đúng là: B
HNO3 là acid mạnh nên là chất điện li.
Câu 7. Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. MgCl2.
B. HClO3.
C. Ba(OH)2.
D. C6H12O6 (glucose).
Đáp án đúng là: D
C6H12O6 (glucose) không phân li ra ion khi hòa tan trong nước.
Loại MgCl2, HClO3, Ba(OH)2 do acid, base và muối có khả năng phân li ra ion khi hoà tan trong nước.
Câu 8. Chất nào sau đây thuộc loại chất điện li mạnh?
A. CH3COOH.
B. C2H5OH.
C. H2O.
D. NaCl.
Đáp án đúng là: D
NaCl là chất điện li mạnh.
Loại A do CH3COOH là acid yếu, chất điện li yếu.
Loại B do C2H5OH là chất không điện li.
Loại C do H2O là chất điện li yếu.
Câu 9. Phương trình điện li viết đúng là
A. H2SO4 → 2H+ + SO4−
B. NaOH Na+ + OH−
C. HF H+ + F-
D. AlCl3 → Al3+ + Cl3-
Đáp án đúng là: C
Phát biểu A sai vì:
Phát biểu B sai vì:
Phát biểu D sai vì:
Câu 10. Phương trình điện li nào sau đây không đúng?
A.
B.
C. HF H+ + F−.
D. BaCl2 → Ba2+ + 2Cl−.
Đáp án đúng là: B
Do K2SO4 là chất điện li mạnh.
Câu 11. Đặc điểm nào sau đây là không đúng khi mô tả về base yếu?
A. Trong dung dịch, không phân li hoàn toàn ra OH−.
B. Có khả năng nhận H+.
C. Dung dịch nước của chúng dẫn điện.
D. Có khả năng cho H+.
Đáp án đúng là: D
Do base là chất có khả năng nhận H+.
Câu 12. Dung dịch chất nào sau đây (có cùng nồng độ) dẫn điện tốt nhất?
A. K2SO4.
B. KOH.
C. NaCl.
D. KNO3.
Đáp án đúng là: A
Do các dung dịch có cùng nồng độ, dung dịch nào có nồng độ ion càng lớn thì dẫn điện càng tốt. Vậy dung dịch K2SO4 dẫn điện tốt nhất.
Câu 13. Nồng độ mol của ion Na+ trong dung dịch Na2SO4 0,2 M là
A. 0,2 M.
B. 0,1 M.
C. 0,4 M.
D. 0,5 M.
Đáp án đúng là: C
Câu 14. Theo thuyết Bronsted – Lowry chất (phân tử và ion) nào sau đây là acid?
A. NaOH.
B. NaCl.
C.
D.
Đáp án đúng là: C
có thể nhường H+, nên là acid theo thuyết Bronsted – Lowry.
Câu 15. Dung dịch chất nào sau đây làm xanh quỳ tím?
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Đáp án đúng là: C
Dung dịch NaOH có môi trường base (pH > 7) nên làm xanh quỳ tím.
Xem thêm các bài tóm tắt Lý thuyết Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác: